题目内容
14.实验室需要90mL 2.0mol/L的Na2CO3溶液,现用无水碳酸钠粉末配制;请回答下列问题:(1)应称取21.2g 无水碳酸钠.
(2)下列仪器中,一定不会用到的是A
A.50mL容量瓶 B.100mL容量瓶 C.玻璃棒;
D.50mL量筒 E.托盘天平 F.药匙
(3)容量瓶在使用前必须进行的操作是查漏.
(4)配制过程简述为以下各步:其正确的操作顺序为CDAGBFE(填各步骤序号).
A.冷却至室温 B.洗涤并转移 C.称量D.溶解 E.摇匀装瓶 F.定容G.转移
(5)在溶液配制过程中,下列情况会使所配溶液浓度偏高的是ACF.
A、溶解固体后的溶液未冷却至室温就移入容量瓶中定容
B、容量瓶在使用前未干燥,里面有少量蒸馏水
C、称量时,砝码生了锈
D、定容摇匀后发现液面低于容量瓶的刻度线,但未做任何处理
E、转移时不小心有溶液溅出瓶外
F、定容时俯视容量瓶的刻度线
(6)在上述所配的Na2CO3溶液中Na+的物质的量浓度为4mol/L,取上述Na2CO3溶液50mL与足量的盐酸反应生成的CO2气体在标况下的体积为2.24L.
分析 (1)根据m=CVM计算需要碳酸钠的质量;
(2)根据配制步骤选择使用仪器,判断用不到的仪器;
(3)容量瓶带有塞子,使用过程中程需要上下颠倒;
(4)根据配制一定物质的量浓度溶液的一般步骤排序;
(5)分析操作对溶质的物质的量和溶液体积的影响,依据C=$\frac{n}{V}$进行误差分析;
(6)依据1mol碳酸钠电离产生2mol钠离子计算钠离子浓度;依据碳酸钠与盐酸反应方程式结合碳原子个数守恒计算生成标况下气体的体积.
解答 解:(1)需要90mL 2.0mol/L的Na2CO3溶液,应选择100mL溶液,配制100mL溶液,需要碳酸钠的质量m=2.0mol/L×0.1L×106g/mol=21.2g;
故答案为:21.2g;
(2)配制100mL 2.0mol•L-1的Na2CO3溶液的操作步骤为:计算、称量、溶解、冷却、转移、洗涤、定容、摇匀等,用到的仪器为:天平、药匙、量筒、烧杯、100mL容量瓶、玻璃棒、胶头滴管;
用不到的仪器为:50mL容量瓶;
故选:A;
(3)容量瓶带有塞子,使用过程中程需要上下颠倒,所以使用前必须检查是否漏水;
故答案为:查漏;
(4)配制一定物质的量浓度溶液的一般步骤:计算、称量、溶解、冷却、转移、洗涤、定容、摇匀,所以正确的顺序为:CDAGBFE;
故答案为:CDAGBFE;
(5)A、溶解固体后的溶液未冷却至室温就移入容量瓶中定容,冷却后,液面下降,溶液体积偏小,溶液浓度偏高,故A选;
B、容量瓶在使用前未干燥,里面有少量蒸馏水,对溶质的物质的量和溶液体积都不会产生影响,溶液浓度不变,故B不选;
C、称量时,砝码生了锈,导致称取的溶质的质量偏大,溶质的物质的量偏大,溶液浓度偏高,故C选;
D、定容摇匀后发现液面低于容量瓶的刻度线,但未做任何处理,操作正确,溶液浓度不变,故D不选;
E、转移时不小心有溶液溅出瓶外,导致溶质的物质的量偏小,溶液浓度偏低,故E不选;
F、定容时俯视容量瓶的刻度线,导致溶液体积偏小,溶液浓度偏高,故F选;
故选:ACF;
(6)1mol碳酸钠电离产生2mol钠离子,所以钠离子浓度为碳酸钠浓度2倍,2.0mol/L的Na2CO3溶液,钠离子浓度为4.0mol/L;
2.0mol/LNa2CO3溶液50mL,含有碳酸钠的物质量为:2.0mol/L×0.05L=0.1mol,
依据碳原子个数守恒:Na2CO3~CO2↑,可知生成二氧化碳物质的量为0.1mol,标况下体积V=0.1mol×22.4L/mol=2.24L;
故答案为:4mol/L; 2.24L.
点评 本题考查了一定物质的量浓度溶液的配制,明确配制原理及操作步骤是解题关键,注意误差分析的方法和技巧.

| A. | 实验使用的主要仪器是分液漏斗 | |
| B. | 溶质溶于萃取剂中所得的溶液不一定有颜色 | |
| C. | 溶质在萃取剂中的溶解度比在原溶剂中的溶解度大 | |
| D. | CCl4、苯、汽油、酒精均可萃取碘水中的碘 |
| A. | 通丙烷的电极为电池负极,发生的电极反应为:C3H8-20e-+10O2-═3CO2+4H2O | |
| B. | 该电池的总反应是:C3H8+5O2═3CO2+4H2O | |
| C. | 电路中每通过5mol电子,约有5.6L标准状况下的丙烷被完全氧化 | |
| D. | 在熔融电解质中,O2-由负极移向正极 |
| A. | c(Na+)=c(NH2-) | B. | c(NH4+)=1×10-29 mol•L-1 | ||
| C. | c(NH2-)>c(NH4+) | D. | c(NH4+).c(NH2-)=1.0×10-30 mol2•L-2 |
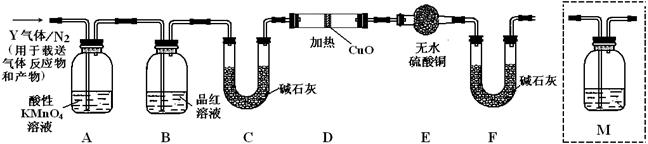 (3)装置B中试剂的作用是检验SO2是否除尽.
(3)装置B中试剂的作用是检验SO2是否除尽.