题目内容
2.图中A为淡黄色的固体,B、C为溶液,D为气体,E、F为白色沉淀物.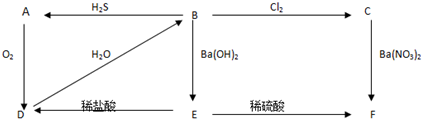
(1)写出下列物质的化学式:
A、S;B、H2SO3;C、H2SO4;D、SO2;E、BaSO3;F、BaSO4.
(2)写出B→C的化学方程式:H2SO3+Cl2+H2O=H2SO4+2HCl.
(3)写出C→F的离子方程式:Ba2++SO42-=BaSO4↓.
分析 A为淡黄色固体,由转化关系可知应为S,则D为SO2,与水反应生成的B为H2SO3,具有还原性,可与氯气发生氧化还原反应,则C为H2SO4,B和氢氧化钡反应生成E为BaSO3,F为BaSO4,结合对应物质的性质以及题目要求解答该题.
解答 解:A为淡黄色固体,由转化关系可知应为S,则D为SO2,与水反应生成的B为H2SO3,具有还原性,可与氯气发生氧化还原反应,则C为H2SO4,B和氢氧化钡反应生成E为BaSO3,F为BaSO4,
(1)由以上分析可知A为S,B为H2SO3,C为H2SO4,D为SO2,E为BaSO3,F为BaSO4,
故答案为:S;H2SO3;H2SO4;SO2;BaSO3;BaSO4;
(2)B为H2SO3,C为H2SO4,H2SO3可被氯气氧化生成硫酸,反应的化学方程式为H2SO3+Cl2+H2O=H2SO4+2HCl,
故答案为:H2SO3+Cl2+H2O=H2SO4+2HCl;
(3)C为H2SO4,F为BaSO4,H2SO4与硝酸钡反应可生成硫酸钡沉淀,反应的离子方程式为Ba2++SO42-=BaSO4↓,
故答案为:Ba2++SO42-=BaSO4↓.
点评 本题考查无机物的推断,侧重于元素化合物知识的综合考查和应用,注意常见含硫物质的性质以及转化关系,难度不大,注意相关基础知识的积累.

练习册系列答案
相关题目
13.根据价层电子对互斥理论,判断下列分子或者离子的空间构型不是平面三角形的是( )
| A. | SO3 | B. | BF3 | C. | CO32- | D. | PH3 |
10.下列气体,可以用排水法收集的是( )
| A. | NO | B. | NH3 | C. | HCl | D. | Cl2 |
17.已知NaBH4中氢元素化合价为-1,反应NaBH4+2H2O═NaBO2+4H2↑中,下列说法正确的是( )
| A. | 被氧化的元素与被还原的元素的质量比为1:1 | |
| B. | NaBH4既是氧化剂又是还原剂 | |
| C. | NaBH4是还原剂,水是氧化剂 | |
| D. | B被氧化,H被还原 |
12.下列说法或表示法正确的是( )
| A. | 等量的硫蒸气和硫固体分别完全燃烧,后者放出热量多 | |
| B. | 由C(石墨)→C(金刚石)△H=+119 kJ•mol-1可知,石墨比金刚石稳定 | |
| C. | 在稀溶液中:H++OH-═H2O△H=-57.3 kJ•mol-1,若将含1mol CH3COOH的醋酸溶液与含1 mol NaOH的溶液混合,放出的热量等于57.3 kJ | |
| D. | 在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)═2H2O(l)△H=+285.8 kJ•mol-1 |