题目内容
10. 某课外兴趣小组进行了中和热测定实验,据此回答下列问题:用50mL 0.50mol/L的盐酸与50mL 0.55mol/L的氢氧化钠溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热.
某课外兴趣小组进行了中和热测定实验,据此回答下列问题:用50mL 0.50mol/L的盐酸与50mL 0.55mol/L的氢氧化钠溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热.(1)图中尚缺少的一种仪器是环形玻璃搅拌棒.
(2)强酸与强碱的稀溶液发生中和反应的热效应:
H+(aq)+OH━(aq)=H2O(1)△H=-57.3kJ/mol.向50mL0.55mol/L的NaOH溶液中加入下列物质:①稀醋酸 ②浓硫酸 ③稀硝酸,恰好完全反应时的热效应△H1、△H2、△H3的关系正确的是D(填序号的字母).
A.△H1>△H2>△H3 B.△H1<△H3<△H2
C.△H1<△H2<△H3 D.△H1>△H3>△H2
(3)下列操作会造成测得中和热的数值偏低的是ABD(填序号的字母).ABDF
A.测量盐酸的温度后,温度计没有用水冲洗干净
B.把量筒中的氢氧化钠溶液倒入小烧杯时动作迟缓
C.做本实验的当天室温较高
D.大烧杯的盖板中间小孔太大
E.在量取盐酸时仰视计数
(4)若用KOH代替NaOH,对测定结果无(填“有”或“无”)影响,若用醋酸代替HCl做实验,对测定结果有(填“有”或“无”)影响.
分析 (1)根据量热计的构造来判断该装置的缺少仪器;
(2)在稀溶液中强酸与强碱生成1molH2O放出的热量为中和热,注意弱电解质的电离吸热,浓硫酸溶于水放热来解答;
(3)根据实验的关键是保温,如果装置有能量散失,则会导致结果偏低,根据实验中用到的试剂以及实验操作知识来判断;
(4)根据中和热的概念分析,弱电解质电离吸热.
解答 解:(1)由量热计的构造可知该装置的缺少仪器是环形玻璃搅拌棒,故答案为:环形玻璃搅拌棒;
(2)强酸与强碱的稀溶液发生中和反应的热效应:H+(aq)+OH-(aq)=H2O(1)△H=-57.3kJ/mol,向50mL0.55mol/L的NaOH溶液中加入下列物质:①稀醋酸;②浓H2SO4;③稀硝酸,醋酸的电离吸热,浓硫酸溶于水放热,则恰好完全反应时的放出的热量为②>③>①,所以△H1>△H3>△H2;
故选:D;
(3)A.测量盐酸的温度后,温度计没有用水冲洗干净,在测碱的温度时,会发生酸和碱的中和,温度偏高,温度变化值减小,所以导致实验测得中和热的数值偏小,故A正确;
B、把量筒中的氢氧化钠溶液倒入小烧杯时动作迟缓,会导致一部分能量的散失,实验测得中和热的数值偏小,故B正确;
C、做本实验的室温和反应热的数据之间无关,故C错误;
D、大烧杯的盖板中间小孔太大,会导致一部分能量的散失,实验测得中和热的数值偏小,故D正确;
E、在量取盐酸时仰视计数,会使得实际量取体积高于所要量的体积,算过量,放出的热量偏多,会使得中和和热的测定数据偏高,故E错误;
故选:ABD;
(4)在稀溶液中,酸跟碱发生中和反应生成1mol水时的反应热叫做中和热,若用KOH代替NaOH,测定结果无影响,醋酸为弱酸,电离过程为吸热过程,所以用醋酸代替HCl做实验,反应放出的热量小于57.3kJ,测定结果偏小,对测定结果有影响,
故答案为:无;有.
点评 本题考查中和热的测定与误差分析,题目难度不大,理解中和热测定原理是解答关键,试题有利于培养学生灵活应用所学知识的能力.

 考前必练系列答案
考前必练系列答案| A. | K1=-K2 | B. | K1=K2 | C. | K1=$\frac{1}{{K}_{2}}$ | D. | K1=$\frac{1}{2}$K2 |
| ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |
| 原子半径(10-10m) | 0.74 | 1.60 | 0.53 | 1.10 | 0.99 | 0.89 | 0.75 | 1.43 |
| 最高或最低化合价 | +2 | +1 | +5 | +7 | +2 | +5 | +3 | |
| -2 | -3 | -1 | -3 |
(2)①④⑦三种元素的氢化物的稳定性由强到弱的顺序为H2O>NH3>PH3(填化学式)
(3)元素④构成的两种单质互称为同素异形体(填“同位素”、“同素异形体”或“同分异构体”)
(4)请写出下列元素形成的常见化合物的电子式:
③⑤
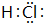 、②⑤
、②⑤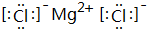 、③⑦
、③⑦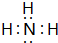
(5)工业制备⑧的过程中,被电解的物质是Al2O3(填化学式),属于离子(填“离子”或“共价”)化合物
(6)请写出⑤⑧两种元素的最高价氧化物对应水化物间反应的离子方程式:3H++Al(OH)3═Al3++3H2O.
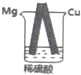
| A. | 是将化学能转化成电能的装置 | |
| B. | Cu上有气体放出 | |
| C. | Mg是负极,电极反应是Mg-2e-═Mg2+ | |
| D. | 导线中有电流通过,电流方向是由Mg到Cu |
| A. | 目前工业废气脱硫应用最广泛的方法是石灰法 | |
| B. | 工业上通过电解熔融的MgCl2获得金属Mg | |
| C. | 钠是一种强还原剂,可以把钛、锆、铌等从其熔融盐中置换出来 | |
| D. | 高炉炼铁的主要反应原理是碳在高温下直接将氧化铁还原成铁 |
| A. | X-a | B. | X-a-n | C. | X-a+n | D. | X+a-n |
| A. | 根据酸分子中含有H原子个数将酸分为一元酸、二元酸 | |
| B. | 根据反应中是否有电子转移将化学反应分为氧化还原反应和非氧化还原反应 | |
| C. | 根据元素原子最外层电子数的多少将元素分为金属元素和非金属元素 | |
| D. | 根据分散系的稳定性大小将混合物分为胶体、溶液和浊液 |
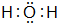 、
、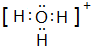 ;
; 有机物在社会生产、生活中起着非常重要的作用.
有机物在社会生产、生活中起着非常重要的作用.