题目内容
16.电解法是最强有力的使氧化还原反应进行的手段,不能自发进行的氧化还原反应,通过电解法可以实现,下列反应需通过电解法来实现的是( )| A. | NaCl+H2O═HCl+NaOH | B. | Cu+H2SO4═CuSO4+H2↑ | ||
| C. | 4HNO3═2H2O+4NO2↑+O2 | D. | 3Fe+4H20(g)═Fe3O4+4H2 |
分析 原电池发生的是自发的氧化还原反应,电解池是强迫下的氧化还原反应,可以将不能自发进行的氧化还原反应通过电解法来实现,据此分析.
解答 解:A、NaCl+H2O═HCl+NaOH不属于氧化还原反应,故A错误;
B、铜不能将氢气置换出来,所以属于外加电源强迫下的氧化还原反应,不能自发进行的氧化还原反应,通过电解的原理可以实现,故B正确;
C、硝酸光照就可以分解,不需通过电解法来实现,故C错误;
D、3Fe+4H20(g)═Fe3O4+4H2,在高温下就可反应,不需通过电解法来实现,故D错误.
故选B.
点评 本题考查了电解的原理和实质,关键是原电池发生的是自发的氧化还原反应,电解池是强迫下的氧化还原反应,难度不大.

练习册系列答案
相关题目
11.下列图示能达到实验目的是( )
| A. |  乙酸乙酯的制备 | B. | 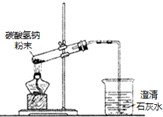 检验碳酸氢钠受热分解的CO2 | ||
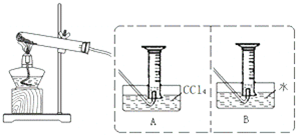
| C. | 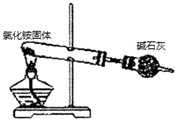 制备氨气 | D. | 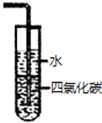 吸收氯气并防倒吸 |
1.若NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 16g CH4与18 g NH4+所含质子数相等 | |
| B. | 0.5mol FeCl3滴入沸水可制备胶体粒子0.5 NA | |
| C. | 将分子总数为NA的NH3和HCl的混合气体置于标准状况下,其体积为约22.4L | |
| D. | 7.8 g Na2O2中含有的离子总数目为0.3NA |
8.在pH=1的溶液中,可以大量共存的离子是( )
| A. | K+、Na +、SO42-、SO32- | B. | NH4+、Mg 2+、SO42-、Cl - | ||
| C. | Na +、K +、HCO3-、Cl - | D. | K +、Na +、NO3-、CO32- |





 .
. 为探究Fe(NO3)2等硝酸盐热分解产物和产物的性质,某化学小组开展如下探究性学习:
为探究Fe(NO3)2等硝酸盐热分解产物和产物的性质,某化学小组开展如下探究性学习: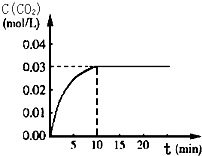 向某一容积为5L的密闭容器中,加入 0.2mol CO和0.2mol H2O,在800℃和催化剂存在的条件下,发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g)△H>0,反应中CO2的浓度随时间变化关系如图所示:
向某一容积为5L的密闭容器中,加入 0.2mol CO和0.2mol H2O,在800℃和催化剂存在的条件下,发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g)△H>0,反应中CO2的浓度随时间变化关系如图所示: