题目内容
【题目】现有A、B、C、D、E、F原子序数依次增大的六种元素,它们位于元素周期表的前四周期。B元素含有3个能级,且毎个能级所含的电子数相同;D的原子核外有8个运动状态不同的电子,E元素与F元素处于同一周期相邻的族,它们的原子序数相差3,且E元素的基态原子有4个未成对电子。请回答下列问题:
(1)请写出D基态的价层电子排布图___________________。
(2)下列说法错误的是___________。
A.二氧化硅的相对分子质量比二氧化碳大,所以沸点:SiO2>CO2
B.电负性顺序:C<N<O<F
C.N2与CO为等电子体,结构相似,化学性质相似
D.稳定性:H2O>H2S,原因是水分子间存在氢键
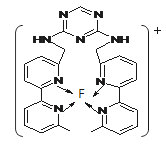
(3)某化合物与F(Ⅰ)(Ⅰ表示化合价为+1)结合形成下图所示的离子,该离子中碳原子的杂化方式是________________________。
(4)己知(BC)2是直线性分子,并有对称性,且分子中每个原子最外层都达到8电子稳定结构,则(BC)2中σ键和π键的个数比为________________。
(5)C元素最高价含氧酸与硫酸酸性强度相近,原因是__________________。
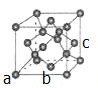
(6) B单质的一种的晶体结构如图所示,则—个晶胞中所含B原子数为____;其中原子坐标参数a为(0,0,0),b为(1/2,1/2,0),则c点原子的坐标参数为_______。
(7)D与F形成离子个数比为1:1的化合物,晶胞与NaCl类似,D离子的配位数是____;设D离子的半径为apm,F离子的半径为bpm,求该晶胞的空间利用率为___________。(列出计算式即可)
【答案】 ![]() ACD sp 2 、sp 3 3:4 HNO3的非羟基氧个数与H2SO4的非羟基氧个数相同,所以酸性强度相近 8 (1,1/2,1/2) 8
ACD sp 2 、sp 3 3:4 HNO3的非羟基氧个数与H2SO4的非羟基氧个数相同,所以酸性强度相近 8 (1,1/2,1/2) 8 ![]()
【解析】B元素含有3个能级,且毎个能级所含的电子数相同,可知B的电子排布式1s22s22p2,所以B为C元素; D的原子核外有8个运动状态不同的电子,因为原子中每个电子的运动状态都是不同的,所以D核外有8个电子,D为O元素;则C为N元素;E元素的基态原子有4个未成对电子,则其电子排布式为〔Ar〕3d44s2或者〔Ar〕3d64s2,前者不符合半充满规律,所以为后者,为Fe元素,即E为26号元素Fe,F与Fe同周期且原子序数相差3,则F为23号元素或者29号元素,23号元素处于第四周期第ⅤB族,而Fe为第Ⅷ族,两者族不相邻,所以F只能为29号元素Cu,Cu处于第四周期ⅠB族,与F e 相邻族。
(1)O原子的价层电子为核外第二层,含有6个电子,其电子排布图为:![]()
(2)A:SiO2为原子晶体,熔沸点高;CO2为分子晶体,熔沸点较低,所以沸点:SiO2>CO2,与相对分子质量的大小无关,而是与晶体的结构有关,A 错误。B:C、N、O、F的非金属性逐渐增大,电负性依次增大,B正确。C:N2与CO均为双原子分子,都含有14个电子,为等电子体,结构相似,化学性质不相似,CO具有较强的还原性,而N2性质很稳定,C 错误。D:O的非金属大于S的非金属性,所以H2O比H2S稳定,与氢键无关,D错误。故答案为ACD
(3)该分子中有两种碳原子,一种是不饱和碳原子,形成的σ键有3个,故该类碳原子的杂化方式为sp2,另一类碳原子为饱和的碳原子,形成的σ键有4个,故该类碳原子的杂化方式为sp3,所以答案为:sp2、sp3。
(4)(BC)2的分子式为(CN)2,为直线分子且对称和满足8电子稳定结构,则其结构为N≡C-C≡N,单键为σ键,一个叁键中含有1个σ键和2个π键,所以σ键和π键个数必为3:4
(5)C的最高价含氧酸为HNO3 ,其结构为HO-NO2 ,H2SO4 的结构为 ,两种酸的非羟基氧原子数目相同,所以两者的酸性相近。答案为:HNO3的非羟基氧个数与H2SO4的非羟基氧个数相同,所以酸性强度相近
,两种酸的非羟基氧原子数目相同,所以两者的酸性相近。答案为:HNO3的非羟基氧个数与H2SO4的非羟基氧个数相同,所以酸性强度相近
(6)B为碳原子,有8个碳原子位于正方体的顶点,6个碳原子位于面心,还有4个碳原子位于正方体内,故一个晶胞中实际含有的碳原子数为8×1/8+6×1/2+4=8个;a原子处于顶点,b原子处于下底面面心,c原子处于右侧面面心,故其原子坐标参数为(1,1/2,1/2)
(7)NaCl晶体中,每个离子的配位数均为8, 故D离子的配位数为8;设晶包边长为x,D 、F离子半径分别为a、b,x=2(a+b),晶包中含有4个D 离子和4个F离子,晶包的体积为[2(a+b)]3,8个离子的体积为4×4π(a3+b3)/3,所以空间利用率为{4×4π(a3+b3)/3}÷[2(a+b)]3=2π(a3+b3)/3(a+b)3

 高效智能课时作业系列答案
高效智能课时作业系列答案 捷径训练检测卷系列答案
捷径训练检测卷系列答案
