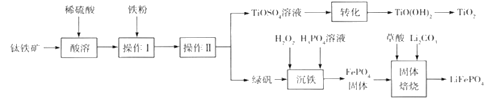
题目内容
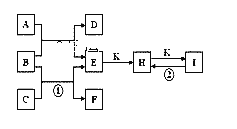
【题目】某同学设计了甲烷燃料电池并探究某些工业电解原理(如图所示),其中乙装置为探究氯碱工业原理(X为阳离子交换膜,C为石墨电极),丙装置为探究粗铜精炼原理。请回答下列问题:
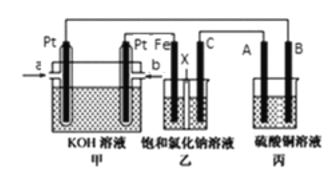
(1)从a口通入的气体为_______。
(2)B电极的电极材料是______。丙池中铜离子浓度______(填“变大”“变小”或不变)。
(3)写出甲中通甲烷一极的电极反应式:________________________________。
(4)写出乙中发生的总反应的离子方程式为________________________________。
【答案】O2 粗铜 变小 CH4-8e-+10OH-=CO32-+7H2O 2Cl-+2H2O![]() Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
【解析】
乙装置为探究氯碱工业原理(X为阳离子交换膜,C为石墨电极),则Fe作阴极、碳作阳极,则燃料电池中b为正极,a为负极;丙中B为阳极,A为阴极。
(1)乙装置为探究氯碱工业原理(X为阳离子交换膜,C为石墨电极),则Fe作阴极、碳作阳极,所以通入a的电极材料是正极、通入b的电极为负极,燃料电池中通入燃料的电极为负极,通入氧化剂的电极为正极,所以从a口通入的气体O2;
(2)丙装置为粗铜精炼,则A为纯铜、B为粗铜;由于阳极的粗铜中的杂质Fe、Zn会放电,而阴极只有Cu2+得电子,则丙中阳极溶解的Cu小于阴极析出的Cu,所以丙池中铜离子浓度变小;
(3)甲中通入甲烷的电极上甲烷失电子和KOH反应生成碳酸钾和水,电极反应式为CH4-8e-+10OH-=CO32-+7H2O;
(4)乙中阳极上氯离子放电生成氯气,阴极上水得电子生成氢气和氢氧根离子,则电池反应式为2Cl-+2H2O![]() Cl2↑+H2↑+2OH-。
Cl2↑+H2↑+2OH-。

练习册系列答案
相关题目