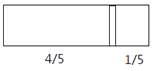
题目内容
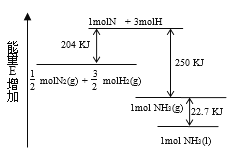
【题目】化学反应N2+3H2→2NH3的能量变化如图所示,该反应的热化学方程式是 ( )
A.![]() N2(g)+
N2(g)+![]() H2(g)→ NH3(l) △H=-46kJ/mol
H2(g)→ NH3(l) △H=-46kJ/mol
B.![]() N2(g)+
N2(g)+ ![]() H2(g)→ NH3(g) △H=-454kJ/mol
H2(g)→ NH3(g) △H=-454kJ/mol
C.N2(g)+3H2(g)→2NH3(g) △H=-92kJ/mol
D.N2(g)+3H2(g)→2NH3(1) △H= +431.3kJ/mol
【答案】C
【解析】
根据反应热等于反应物旧键断裂吸收的总能量减去生成物新键形成所放出总能量计算反应热,然后根据并热化学方程式的书写方法写出热化学方程式,注意反应物的物质的量和生成物的聚集状态。
由图可以看出,![]() molN2(g)+
molN2(g)+![]() molH2(g)断键吸收的能量为204kJ,形成1molNH3(g)的放出的能量为250kJ,所以
molH2(g)断键吸收的能量为204kJ,形成1molNH3(g)的放出的能量为250kJ,所以![]() N2(g)+
N2(g)+![]() H2(g)=NH3(g)△H=-46kJ/mol,而1mol的NH3(g)转化为1mol的NH3(l)放出的热量为22.7kJ,根据盖斯定律可知:
H2(g)=NH3(g)△H=-46kJ/mol,而1mol的NH3(g)转化为1mol的NH3(l)放出的热量为22.7kJ,根据盖斯定律可知:![]() N2(g)+
N2(g)+![]() H2(g)=NH3(l) △H=-68.7kJ/mol,即:N2(g)+3H2(g)=2NH3(g) △H=-92kJ/mol,N2(g)+3H2(g)=2NH3(l) △H=-137.4kJ/mol,故合理选项是C。
H2(g)=NH3(l) △H=-68.7kJ/mol,即:N2(g)+3H2(g)=2NH3(g) △H=-92kJ/mol,N2(g)+3H2(g)=2NH3(l) △H=-137.4kJ/mol,故合理选项是C。

练习册系列答案
相关题目