题目内容
20.H2SO4的摩尔质量为98g/mol.1.204×1024个H2SO4分子物质的量为2mol,其中含8mol O,含H的质量为4g.分析 摩尔质量以g/mol为单位,数值上等于其相对分子质量,根据n=$\frac{N}{{N}_{A}}$计算硫酸的物质的量,氧原子物质的量为硫酸的4倍,H的物质的量为硫酸的2倍,根据m=nM计算H的质量.
解答 解:H2SO4的摩尔质量为98g/mol,1.204×1024个H2SO4分子物质的量为$\frac{1.204×1{0}^{24}}{6.02×1{0}^{23}}$=2mol,其中含有氧原子为2mol×4=8mol,H的物质的量为硫酸的2倍,则H的物质的量为4mol,H的质量为4mol×1g/mol=4g,
故答案为:98g/mol;2mol;8;4g.
点评 本题考查物质的量有关计算,比较基础,旨在考查学生对基础知识的巩固,侧重于考查学生的分析能力和计算能力.

练习册系列答案
 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案
相关题目
10.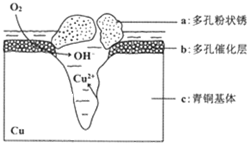 我国古代青铜器工艺精湛,有很高的艺术价值和历史价值,但出土的青铜器大多受到环境腐蚀,故对其进行修复和防护具有重要意义. 右图为青铜器在潮湿环境中发生电化学腐蚀的原理示意图.下列说法不正确的是( )
我国古代青铜器工艺精湛,有很高的艺术价值和历史价值,但出土的青铜器大多受到环境腐蚀,故对其进行修复和防护具有重要意义. 右图为青铜器在潮湿环境中发生电化学腐蚀的原理示意图.下列说法不正确的是( )
 我国古代青铜器工艺精湛,有很高的艺术价值和历史价值,但出土的青铜器大多受到环境腐蚀,故对其进行修复和防护具有重要意义. 右图为青铜器在潮湿环境中发生电化学腐蚀的原理示意图.下列说法不正确的是( )
我国古代青铜器工艺精湛,有很高的艺术价值和历史价值,但出土的青铜器大多受到环境腐蚀,故对其进行修复和防护具有重要意义. 右图为青铜器在潮湿环境中发生电化学腐蚀的原理示意图.下列说法不正确的是( )| A. | 腐蚀过程中,负极是a | |
| B. | 正极反应是 O2+4e-+2H2O═4OH- | |
| C. | 若生成4.29 g Cu2(OH)3Cl,则理论上耗氧体积为0.224L(标准状况) | |
| D. | 环境中的Cl-扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔粉状锈Cu2(OH)3Cl,其离子方程式为2Cu2++3OH-+Cl-═Cu2(OH)3Cl↓ |
11.下列反应中,属于取代反应的是( )
| A. | CH4+2 O2 $\stackrel{点燃}{→}$ CO2+2H2O | |
| B. | CH2=CH2+H2 $\stackrel{催化剂}{→}$ CH3-CH3 | |
| C. |  +Br2 $\stackrel{FeBr_{3}}{→}$ +Br2 $\stackrel{FeBr_{3}}{→}$ +HBr +HBr | |
| D. | 2CH3CH2OH+O2 $→_{△}^{Cu或Ag}$ 2CH3CHO+2 H2O |
8. 合成氨反应N2(g)+3H2(g)$?_{催化剂}^{高温高压}$ 2NH3(g)△H<0 具有重要的意义.
合成氨反应N2(g)+3H2(g)$?_{催化剂}^{高温高压}$ 2NH3(g)△H<0 具有重要的意义.
(1)①该反应的化学平衡常数表达式是K=$\frac{[NH{\;}_{3}]^{2}}{[N{\;}_{2}][H{\;}_{2}]{\;}^{3}}$.
②该反应的化学平衡常数K与温度T的关系如下表所示:
其中,K1> K2(填“>”、“=”或“<”).
③理论上,为了增大平衡时H2的转化率,可采取的措施是a、d.(填序号)
a.增大压强 b.使用合适的催化剂
c.升高温度 d.及时分离出产物中的NH3
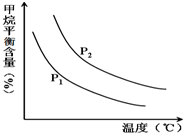
(2)原料气H2可通过反应 CH4(g)+H2O (g)═CO(g)+3H2(g) 获取,已知该反应中,当初始混合气中的 $\frac{n({H}_{2}O)}{n(C{H}_{4})}$恒定时,温度、压强对平衡混合气CH4含量的影响如图所示:
①图中,两条曲线表示压强的关系是:P1<P2(填“>”、“=”或“<”).
②该反应为吸热反应(填“吸热”或“放热”).
(3)原料气H2还可通过反应CO(g)+H2O(g)═CO2 (g)+H2(g) 获取.
①T℃时,向容积固定为5L的容器中充入1mol水蒸气和1mol CO,反应达平衡后,测得CO的浓度为0.08mol•L-1,则平衡时CO的转化率为60%,该温度下反应的平衡常数K值为2.25.
②保持温度仍为T℃,改变水蒸气和CO的初始物质的量之比,充入容器进行反应,下列描述能够说明体系处于平衡状态的是cd(填序号).
a.容器内压强不随时间改变
b.混合气体的密度不随时间改变
c.单位时间内生成a mol CO2的同时消耗a mol H2
d.混合气中n (CO):n (H2O):n (CO2):n (H2)=1:16:6:6.
 合成氨反应N2(g)+3H2(g)$?_{催化剂}^{高温高压}$ 2NH3(g)△H<0 具有重要的意义.
合成氨反应N2(g)+3H2(g)$?_{催化剂}^{高温高压}$ 2NH3(g)△H<0 具有重要的意义.(1)①该反应的化学平衡常数表达式是K=$\frac{[NH{\;}_{3}]^{2}}{[N{\;}_{2}][H{\;}_{2}]{\;}^{3}}$.
②该反应的化学平衡常数K与温度T的关系如下表所示:
| T/K | 473 | 573 | 673 | … |
| K | 4.4×10-2 | K1 | K2 | … |
③理论上,为了增大平衡时H2的转化率,可采取的措施是a、d.(填序号)
a.增大压强 b.使用合适的催化剂
c.升高温度 d.及时分离出产物中的NH3
(2)原料气H2可通过反应 CH4(g)+H2O (g)═CO(g)+3H2(g) 获取,已知该反应中,当初始混合气中的 $\frac{n({H}_{2}O)}{n(C{H}_{4})}$恒定时,温度、压强对平衡混合气CH4含量的影响如图所示:
①图中,两条曲线表示压强的关系是:P1<P2(填“>”、“=”或“<”).
②该反应为吸热反应(填“吸热”或“放热”).
(3)原料气H2还可通过反应CO(g)+H2O(g)═CO2 (g)+H2(g) 获取.
①T℃时,向容积固定为5L的容器中充入1mol水蒸气和1mol CO,反应达平衡后,测得CO的浓度为0.08mol•L-1,则平衡时CO的转化率为60%,该温度下反应的平衡常数K值为2.25.
②保持温度仍为T℃,改变水蒸气和CO的初始物质的量之比,充入容器进行反应,下列描述能够说明体系处于平衡状态的是cd(填序号).
a.容器内压强不随时间改变
b.混合气体的密度不随时间改变
c.单位时间内生成a mol CO2的同时消耗a mol H2
d.混合气中n (CO):n (H2O):n (CO2):n (H2)=1:16:6:6.
15.下列各组的两种物质在溶液中反应,可用同一离子方程式表示的是( )
| A. | 氢氧化铜与盐酸、氢氧化钡与盐酸 | |
| B. | 石灰石和硝酸溶液、石灰石与盐酸溶液 | |
| C. | BaCO3与HCl溶液、Na2CO3溶液NaHSO4 | |
| D. | 石灰水中通CO2、石灰水中通SO2 |
5.下列反应的离子方程式正确的是( )
| A. | 碳酸钙和稀盐酸反应:CO32-+2H+═H2O+CO2↑ | |
| B. | 铁粉和稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| C. | 向澄清石灰水中通入少量CO2:Ca2++2OH-+CO2═CaCO3↓+H2O | |
| D. | 硫酸铜溶液和氢氧化钡溶液混合:SO42-+Ba2+═BaSO4↓ |
12.下列与实验相关的叙述正确的是( )
| A. | 稀释浓硫酸时,应将蒸馏水沿玻璃棒缓慢注入浓硫酸中 | |
| B. | 配制溶液时,若加水超过容量瓶刻度,应用胶头滴管将多余溶液吸出 | |
| C. | 蒸馏时蒸馏烧瓶中液体的体积不能超过其容积的规格,液体也不能蒸干 | |
| D. | 检验某溶液是否含有SO42-时,应取少量该溶液,依次加入BaCl2溶液和稀盐酸 |