题目内容
12.下列与实验相关的叙述正确的是( )| A. | 稀释浓硫酸时,应将蒸馏水沿玻璃棒缓慢注入浓硫酸中 | |
| B. | 配制溶液时,若加水超过容量瓶刻度,应用胶头滴管将多余溶液吸出 | |
| C. | 蒸馏时蒸馏烧瓶中液体的体积不能超过其容积的规格,液体也不能蒸干 | |
| D. | 检验某溶液是否含有SO42-时,应取少量该溶液,依次加入BaCl2溶液和稀盐酸 |
分析 A.稀释浓硫酸时,应该将浓硫酸加入水中而不是将水加入浓硫酸中;
B.配制溶液时,若加水超过容量瓶刻度,应该重新配制;
C.蒸馏时,液体不能太多,且不能蒸干,利用余热加热;
D.检验某溶液是否含有SO42-时,应取少量该溶液,依次加稀盐酸和入BaCl2溶液.
解答 解:A.稀释浓硫酸时,应该将浓硫酸加入水中而不是将水加入浓硫酸中,且稀释浓硫酸时要不断搅拌,故A错误;
B.配制溶液时,若加水超过容量瓶刻度,应该重新配制,如果用胶头滴管将多余溶液吸出,吸出的溶液中含有溶质,导致配制溶液浓度偏低,故B错误;
C.蒸馏时,液体不能太多,且不能蒸干,利用余热加热,则蒸馏烧瓶中液体的体积不能超过容积的$\frac{2}{3}$,液体也不能蒸干,故C正确;
D.检验某溶液是否含有SO42-时,应取少量该溶液,依次加稀盐酸和入BaCl2溶液,用稀盐酸除去碳酸根离子、亚硫酸根离子等离子干扰,故D错误;
故选C.
点评 本题考查化学实验方案评价,为高频考点,涉及离子检验、蒸馏、溶液配制、溶液稀释等知识点,明确实验原理、基本操作规范性是解本题关键,易错选项是D,注意溶液滴加先后顺序,题目难度不大.

练习册系列答案
 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案
相关题目
2.下列关于实验的叙述中正确的有 ( )
| A. | 不慎碰翻燃着的酒精灯使酒精在桌面上燃烧起来,应立即用湿抺布灭火 | |
| B. | 不慎将酸沾到皮肤或衣物上,应立即用浓NaOH溶液清洗 | |
| C. | 用托盘天平称量物品质量时,物品应置于右盘 | |
| D. | 实验时应节约药品,实验剩余的药品应放回原试剂瓶 | |
| E. | 可燃性气体点燃前一定要验纯 | |
| F. | 可燃性气体点燃前一定要验纯 |
4.海水资源丰富,海水中主要含有Na+、K+、Mg2+、Cl-、SO${\;}_{4}^{2-}$、Br-、CO${\;}_{3}^{2-}$、HCO${\;}_{3}^{-}$等离子.合理利用海水资源和保护环境是我国可持续发展的重要保证.
Ⅰ.火力发电燃煤排放的SO2会造成一系列环境和生态问题.利用海水脱硫是一种有效的方法,其工艺流程如图所示:
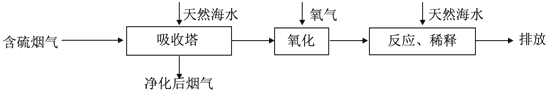
(1)天然海水的pH≈8,呈弱碱性.用离子方程式解释原因CO32-+H2O?HCO3-+OH-,HCO3-+H2O?H2CO3+OH-.
(2)天然海水吸收了含硫烟气后,要用O2进行氧化处理,其反应的化学方程式是2H2SO3+O2=2H2SO4.
氧化后的“海水”需要用大量的天然海水与之混合后才能排放,该操作的主要目的是中和、稀释经氧气氧化后海水中生成的酸.
Ⅱ.重金属离子对河流及海洋造成严重污染.某化工厂废水(pH=2.O,p≈1g•mL-1)中含有Ag+、Pb2+等重金属离子,其浓度各约为0.01mol•L-1.排放前拟用沉淀法除去这两种离子,查找有关数据如下:
(3)你认为往废水中投入B (填字母序号),沉淀效果最好.
A.NaOH B.Na2S C.KI D.Ca(OH)2
(4)如果用生石灰处理上述废水,使溶液的pH=8.0,处理后的废水中c(Pb2+)=1.2×10-3mol•L-1.
(5)如果用食盐处理其只含Ag+的废水,测得处理后废水中NaCl的质量分数为0.117%.
若环境要求排放标准为c(Ag+)低于1.O×lO-8mol•L-1,问该工厂处理后的废水中c(Ag+)=9×10-9mol•L-1,是否符合排放标准是 (填“是”或“否”).已知KSP(AgCl)=1.8×l-10mol2•L2.
Ⅰ.火力发电燃煤排放的SO2会造成一系列环境和生态问题.利用海水脱硫是一种有效的方法,其工艺流程如图所示:

(1)天然海水的pH≈8,呈弱碱性.用离子方程式解释原因CO32-+H2O?HCO3-+OH-,HCO3-+H2O?H2CO3+OH-.
(2)天然海水吸收了含硫烟气后,要用O2进行氧化处理,其反应的化学方程式是2H2SO3+O2=2H2SO4.
氧化后的“海水”需要用大量的天然海水与之混合后才能排放,该操作的主要目的是中和、稀释经氧气氧化后海水中生成的酸.
Ⅱ.重金属离子对河流及海洋造成严重污染.某化工厂废水(pH=2.O,p≈1g•mL-1)中含有Ag+、Pb2+等重金属离子,其浓度各约为0.01mol•L-1.排放前拟用沉淀法除去这两种离子,查找有关数据如下:
| 难溶电解质 | AgI | AgOH | Ag2S | PbI2 | Pb(OH)2 | PbS |
| KSP | 8.3×10-17 | 5.6×10-8 | 6.3×10-50 | 7.1×10-9 | 1.2×10-15 | 3.4×10-28 |
A.NaOH B.Na2S C.KI D.Ca(OH)2
(4)如果用生石灰处理上述废水,使溶液的pH=8.0,处理后的废水中c(Pb2+)=1.2×10-3mol•L-1.
(5)如果用食盐处理其只含Ag+的废水,测得处理后废水中NaCl的质量分数为0.117%.
若环境要求排放标准为c(Ag+)低于1.O×lO-8mol•L-1,问该工厂处理后的废水中c(Ag+)=9×10-9mol•L-1,是否符合排放标准是 (填“是”或“否”).已知KSP(AgCl)=1.8×l-10mol2•L2.
1.下列有关合金的说法正确的是( )
| A. | 合金必须是由两种或两种以上的金属组成 | |
| B. | 水银是合金 | |
| C. | 形成合金后,其熔点一般会提高 | |
| D. | 形成合金后,其硬度一般会增大 |
2.下列说法正确的是( )
| A. | 不同原子构成的物质可能是单质、化合物或混合物 | |
| B. | 酸性氧化物一定是非金属氧化物 | |
| C. | 电解质溶液导电、煤的气化、石油的裂解、烧碱的潮解都是化学变化 | |
| D. | 化学变化中往往伴随着化学键的破坏与形成,而物理变化中一定没有化学键的破坏或形成 |
 水的电离平衡如图所示.
水的电离平衡如图所示.