题目内容
【题目】某化学小组模拟喷泉实验原理并探究NH3的有关性质。实验过程如下,如图所示,在干燥的圆底烧瓶里充满氨气,用带有玻璃管和滴管(滴管里预先吸入水)的塞子塞紧瓶口。倒置烧瓶,使玻璃管插入盛有水的烧杯中(预先在水里滴入少量酚酞溶液)。轻轻挤压滴管,使少量水进入烧瓶,打开活塞f。回答下列问题:
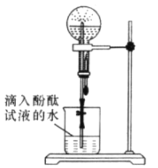
(1)本实验的现象是_________,本实验得到NH3的哪些性质_______
(2)下列可以产生类似现象的组合为____________
a(干燥气体) | b(液体) | ||
A | NO | 水 | |
B | CO2 | 4mol/LNaOH溶液 | |
C | Cl2 | 饱和NaCl溶液 | |
D | NH3 | 1mol/L盐酸 | |
(3)同温同压下,分别充满①NO2②NH3进行喷泉实验,经充分反应后,圆底烧瓶内溶液的物质的量浓度①_____②(填“<”“>”或“=”)
(4)实验室制备氨气的装置如图所示,反应方程式为____________________________,该装置_____(“能”或“不能”)用于加热碳酸氢铵固体来制备纯净的氨气,原因________________________________________
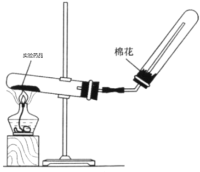
【答案】产生红色喷泉 氨气极易溶于水,氨水显碱性 BD = 2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O 能 碱石灰可以吸收CO2、H2O
CaCl2+2NH3↑+2H2O 能 碱石灰可以吸收CO2、H2O
【解析】
(1)本实验的现象是产生红色喷泉,因为氨气极易溶于水,氨水显碱性;
(2)能形成喷泉,必须使烧瓶里压强迅速下降;
(3)在相同条件下,气体摩尔体积相同,烧瓶的容积相同,根据n=V/Vm知,氨气、NO2的物质的量之比为1: 1,因NO2能与水反应: 3NO2+H2O=2HNO3+NO,根据NO2与HNO3的计量数之比,所以硝酸的物质的量为二氧化氮物质的量的2/3,所以各烧瓶中溶质的物质的量之比为3: 2;做喷泉实验时,盛放氨气的烧瓶能充满溶液,含NO2的烧瓶溶液进入2/3,所以溶液的体积为3: 2, 所以各物质的量浓度之比为1:1。
(4)实验室制备氨气的反应方程式为:2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O,该装置能用于加热碳酸氢铵固体来制备纯净的氨气,原因是碱石灰可以吸收碳酸氢铵分解产生的CO2、H2O。
CaCl2+2NH3↑+2H2O,该装置能用于加热碳酸氢铵固体来制备纯净的氨气,原因是碱石灰可以吸收碳酸氢铵分解产生的CO2、H2O。
(1)本实验的现象是产生红色喷泉,因为氨气极易溶于水,氨水显碱性,故答案为:产生红色喷泉;氨气极易溶于水,氨水显碱性。
(2)A.NO不溶于水,故不能形成喷泉,故A不选;
B.CO2和NaOH溶液反应,能形成喷泉,故B选;
C.Cl2在饱和NaCl溶液中溶解度很小,不能形成喷泉,故C不选;
D. NH3和盐酸反应,能形成喷泉,故D选;
故选BD。
(3)在相同条件下,气体摩尔体积相同,烧瓶的容积相同,根据n=V/Vm知,氨气、NO2的物质的量之比为1: 1,因NO2能与水反应: 3NO2+H2O=2HNO3+NO,根据NO2与HNO3的计量数之比,所以硝酸的物质的量为二氧化氮物质的量的2/3,所以各烧瓶中溶质的物质的量之比为3: 2;做喷泉实验时,盛放氨气的烧瓶能充满溶液,含NO2的烧瓶溶液进入2/3,所以溶液的体积为3: 2, 所以各物质的量浓度之比为1:1,故答案为:=。
(4)实验室制备氨气的反应方程式为:2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O,该装置能用于加热碳酸氢铵固体来制备纯净的氨气,原因是碱石灰可以吸收碳酸氢铵分解产生的CO2、H2O,故答案为:2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O,该装置能用于加热碳酸氢铵固体来制备纯净的氨气,原因是碱石灰可以吸收碳酸氢铵分解产生的CO2、H2O,故答案为:2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O ;能 ;碱石灰可以吸收CO2、H2O。
CaCl2+2NH3↑+2H2O ;能 ;碱石灰可以吸收CO2、H2O。

 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案【题目】已知:H2(g)+I2(g)![]() 2HI(g)△H=-14.9kJ·mol-1。某温度下,在体积均为2.0L的甲、乙两个恒容密闭容器中充入反应物,其起始物质的量如下表所示。甲中反应达到平衡时,测得c(H2)=0.008mol·L-1。下列判断正确的是( )
2HI(g)△H=-14.9kJ·mol-1。某温度下,在体积均为2.0L的甲、乙两个恒容密闭容器中充入反应物,其起始物质的量如下表所示。甲中反应达到平衡时,测得c(H2)=0.008mol·L-1。下列判断正确的是( )
起始物质的量 | n(H2)/mol | n(I2)/mol | n(HI)/mol |
甲 | 0.02 | 0.02 | 0 |
乙 | 0.04 | 0.04 | 0 |
A. 平衡时,乙中H2的转化率是甲中的2倍
B. 平衡时,甲中混合物的颜色比乙中深
C. 平衡时,甲、乙中热量的变化值相等
D. 该温度下,反应的平衡常数K=0.25
【题目】某课外学习小组在学习了![]() 与
与![]() 的反应后,认为
的反应后,认为![]() 与
与![]() 应该也可以反应。他们设计了如图装置
应该也可以反应。他们设计了如图装置![]() 夹持装置已略去,装置的气密性良好
夹持装置已略去,装置的气密性良好![]() 进行实验,探究
进行实验,探究![]() 与
与![]() 反应的产物,请按要求回答下列问题。
反应的产物,请按要求回答下列问题。

Ⅰ![]() 写出装置A中发生反应的化学方程式:______。
写出装置A中发生反应的化学方程式:______。
Ⅱ![]() 装置D的作用:除了可以防止空气中的
装置D的作用:除了可以防止空气中的![]() 、水蒸气等进入C中与
、水蒸气等进入C中与![]() 反应,还可以______________________________________________________。
反应,还可以______________________________________________________。
Ⅲ![]() 在通入足量的
在通入足量的![]() 与
与![]() 充分反应后,他们对C中固体产物提出如下假设:
充分反应后,他们对C中固体产物提出如下假设:
假设1:只有![]() ;
;
假设2:___________;
假设3:既有![]() ,又有
,又有![]() 。
。
(1)若假设2成立,写出![]() 与
与![]() 反应的化学方程式:_________________。
反应的化学方程式:_________________。
(2)某同学设计了如下实验进一步确认产物的成分。
实验步骤 | 现象 |
| 固体全部溶解 |
| 酸性 |
| 产生白色沉淀 |
步骤![]() 中将产生的气体通入少量酸性
中将产生的气体通入少量酸性![]() 溶液中,发生反应的离子方程式为:______。通过上述实验现象确定假设______成立。
溶液中,发生反应的离子方程式为:______。通过上述实验现象确定假设______成立。![]() 选填1、2或
选填1、2或![]()
