题目内容
11.下列反应中氯气既作氧化剂又作还原剂的是( )| A. | 用氯气制备漂白粉 | B. | 氯气和铜 | ||
| C. | 氯气和氢气 | D. | 浓盐酸与二氧化锰反应生成氯气 |
分析 含氯气既作氧化剂又作还原剂,则反应中Cl元素的化合价既升高又降低,以此来解答.
解答 解:A.用氯气制备漂白粉,反应生成氯化钙、次氯酸钙和水,反应中反应中Cl元素的化合价既升高又降低,既作氧化剂又作还原剂,故A选;
B.氯气和铜,元素的化合价只降低,作氧化剂,故B不选;
C.氯气和氢气,元素的化合价只降低,作氧化剂,故C不选;
D.浓盐酸与二氧化锰反应生成氯气,Cl元素的化合价只升高,氯气是生成物是氧化产物,故D不选;
故选A.
点评 本题考查氧化还原反应,为高频考点,把握发生的氧化还原反应及元素的化合价变化为解答的关键,注意从元素化合价角度分析,题目难度不大.

练习册系列答案
 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案
相关题目
1. 工业制氢气的一个重要反应是:CO(g)+H2O(g)?CO2(g)+H2(g)△H<0
工业制氢气的一个重要反应是:CO(g)+H2O(g)?CO2(g)+H2(g)△H<0
现将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中进行反应,得到如下三组数据:
①对于反应CO(g)+H2O(g)?CO2(g)+H2(g),下列说法正确的是AD
A.当容器中CO的含量保持不变时,说明该反应达到平衡状态
B.若混合气体的密度不再改变,说明该反应已达化学平衡状态
C.实验I中,反应达到平衡后,再通入4molCO和2molH2O,平衡正向移动,H2的体积分数增大
D.若使用催化剂,会改变反应的途径,但反应的焓变不变
②实验I中,从反应开始到反应达到平衡时,CO的平均反应速率V(CO)=0.16mol/(L.min);
③实验II条件下反应的平衡常数K=0.33 (保留小数点后二位);H2O(g)的平衡转化率为50%.
④若在900℃时,实验II反应达到平衡后,向此容器中再加入1.5molCO、0.5mol H2O、0.2mol CO2、0.5mol H2,则平衡向正反应方向移动(填“正反应”、“逆反应”或“不移动”)
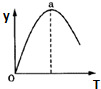
⑤若仅改变温度,纵坐标y随T变化如图所示,则纵坐标y表示的是AC.
A.CO2的百分含量 B.混合气体的平均相对分子质量C.CO的转化率 D.H2O的物质的量.
 工业制氢气的一个重要反应是:CO(g)+H2O(g)?CO2(g)+H2(g)△H<0
工业制氢气的一个重要反应是:CO(g)+H2O(g)?CO2(g)+H2(g)△H<0现将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中进行反应,得到如下三组数据:
| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡状态所需时间/min | ||
| CO | H2O | H2 | CO2 | |||
| Ⅰ | 650 | 4 | 2 | 1.6 | 1.6 | 5 |
| Ⅱ | 900 | 2 | 1 | 0.5 | 0.5 | 3 |
A.当容器中CO的含量保持不变时,说明该反应达到平衡状态
B.若混合气体的密度不再改变,说明该反应已达化学平衡状态
C.实验I中,反应达到平衡后,再通入4molCO和2molH2O,平衡正向移动,H2的体积分数增大
D.若使用催化剂,会改变反应的途径,但反应的焓变不变
②实验I中,从反应开始到反应达到平衡时,CO的平均反应速率V(CO)=0.16mol/(L.min);
③实验II条件下反应的平衡常数K=0.33 (保留小数点后二位);H2O(g)的平衡转化率为50%.
④若在900℃时,实验II反应达到平衡后,向此容器中再加入1.5molCO、0.5mol H2O、0.2mol CO2、0.5mol H2,则平衡向正反应方向移动(填“正反应”、“逆反应”或“不移动”)
⑤若仅改变温度,纵坐标y随T变化如图所示,则纵坐标y表示的是AC.
A.CO2的百分含量 B.混合气体的平均相对分子质量C.CO的转化率 D.H2O的物质的量.
2.实现“节能减排”和“低碳经济”的一项重要课题就是如何将CO2转化为可利用的资源.
Ⅰ.目前工业上有一种方法是用CO2与H2来生产燃料甲醇.一定条件下发生反应:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g),图1表示该反应过程中能量变化:

(1)关于该反应的下列说法中,正确的是C(填字母).
A.△H>0,△S>0 B.△H>0,△S<0
C.△H<0,△S<0 D.△H<0,△S>0
(2)为探究反应原理,现进行如下实验,在体积为l L的密闭容器中,充入l mol CO2和4mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如图2所示.
①从反应开始到平衡,CO2的平均反应速率v(CO2)=0.075mol/(L•min).
②H2的平衡转化率为56.25%.
③下列措施中能使化学平衡向正反应方向移动的是B(填字母).
A.升高温度 B.将CH3OH(g)及时液化抽出 C.选择高效催化剂
Ⅱ.在一定体积的密闭容器中,进行如下化学反应CO2(g)+H2(g)?CO(g)+H2O(g),其中化学平衡常数K和温度的关系如表:
(1)该反应的平衡常数表达式K=$\frac{c(CO)•c({H}_{2}O)}{c(C{O}_{2})•c({H}_{2})}$.此反应为吸热反应(填“放热”或“吸热”)
(2)在830℃下,在10L容器中含有1molCO2、1.2molH2、0.75molCO、1.5molH2O,则此时反应v(N2)正> v(N2)逆(填“>”、“<”、“=”),对此反应状态的描述正确的为B(填下列序号)
A.恰好处于平衡状态 B.向正反应方向进行 C.向逆反应方向进行.
Ⅰ.目前工业上有一种方法是用CO2与H2来生产燃料甲醇.一定条件下发生反应:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g),图1表示该反应过程中能量变化:

(1)关于该反应的下列说法中,正确的是C(填字母).
A.△H>0,△S>0 B.△H>0,△S<0
C.△H<0,△S<0 D.△H<0,△S>0
(2)为探究反应原理,现进行如下实验,在体积为l L的密闭容器中,充入l mol CO2和4mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如图2所示.
①从反应开始到平衡,CO2的平均反应速率v(CO2)=0.075mol/(L•min).
②H2的平衡转化率为56.25%.
③下列措施中能使化学平衡向正反应方向移动的是B(填字母).
A.升高温度 B.将CH3OH(g)及时液化抽出 C.选择高效催化剂
Ⅱ.在一定体积的密闭容器中,进行如下化学反应CO2(g)+H2(g)?CO(g)+H2O(g),其中化学平衡常数K和温度的关系如表:
| t/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(2)在830℃下,在10L容器中含有1molCO2、1.2molH2、0.75molCO、1.5molH2O,则此时反应v(N2)正> v(N2)逆(填“>”、“<”、“=”),对此反应状态的描述正确的为B(填下列序号)
A.恰好处于平衡状态 B.向正反应方向进行 C.向逆反应方向进行.
19.下列物质放置在空气中,不是因发生氧化还原反应而变质的是( )
| A. | 金属钠 | B. | 氢氧化钠 | C. | 过氧化钠 | D. | 氯水 |
6.氧化还原反应的实质是( )
| A. | 氧原子的得失 | B. | 化合价的升降 | ||
| C. | 分子中原子重新组合 | D. | 电子的转移 |
20.向稀硫酸溶液中加入铜粉不发生反应,若再加入下列某种物质,则铜粉可以溶解.符合此条件的物质是( )
| A. | FeCl2 | B. | KNO3 | C. | FeSO4 | D. | HCl |
1.有关合理用药的下列说法中,错误的是( )
| A. | 对症下药是合理用药的首要原则 | |
| B. | 能被充分、快速吸收而无刺激性的药物,可在饭前口服 | |
| C. | 服药一般用温开水,止咳糖浆也可用水冲服 | |
| D. | 一种药物的用量,是经过严格的科学实验和大量的临床研究确定的 |
 .
.