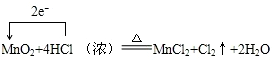题目内容
2.实现“节能减排”和“低碳经济”的一项重要课题就是如何将CO2转化为可利用的资源.Ⅰ.目前工业上有一种方法是用CO2与H2来生产燃料甲醇.一定条件下发生反应:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g),图1表示该反应过程中能量变化:

(1)关于该反应的下列说法中,正确的是C(填字母).
A.△H>0,△S>0 B.△H>0,△S<0
C.△H<0,△S<0 D.△H<0,△S>0
(2)为探究反应原理,现进行如下实验,在体积为l L的密闭容器中,充入l mol CO2和4mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如图2所示.
①从反应开始到平衡,CO2的平均反应速率v(CO2)=0.075mol/(L•min).
②H2的平衡转化率为56.25%.
③下列措施中能使化学平衡向正反应方向移动的是B(填字母).
A.升高温度 B.将CH3OH(g)及时液化抽出 C.选择高效催化剂
Ⅱ.在一定体积的密闭容器中,进行如下化学反应CO2(g)+H2(g)?CO(g)+H2O(g),其中化学平衡常数K和温度的关系如表:
| t/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(2)在830℃下,在10L容器中含有1molCO2、1.2molH2、0.75molCO、1.5molH2O,则此时反应v(N2)正> v(N2)逆(填“>”、“<”、“=”),对此反应状态的描述正确的为B(填下列序号)
A.恰好处于平衡状态 B.向正反应方向进行 C.向逆反应方向进行.
分析 I.(1)正反应气体的物质的量减少,混乱度减小;由于反应物能量高于生成物的能量,反应是放热反应;
(2)二氧化碳是反应物,随反应进行浓度减小,甲醇是生成物,随反应进行浓度增大,10nim内达到平衡,生成甲醇浓度为0.75mol/L,二氧化碳浓度变化了0.75mol/L,则:
CO2(g)+3H2(g)═CH3OH(g)+H2O(g)
起始量(mol/L):1 4 0 0
变化量(mol/L):0.75 2.25 0.75 0.75
平衡量(mol/L):0.25 1.75 0.75 0.75
①根据c=$\frac{△c}{△t}$计算v(CO2);
②氢气转化率=$\frac{氢气浓度变化量}{氢气起始浓度}$×100%;
③A.反应是放热反应,升温平衡逆向进行;
B.将CH3OH(g)及时液化抽出,减小生成物的量平衡正向进行;
C.选择高效催化剂只能改变速率,不改变化学平衡;
Ⅱ.(1)化学平衡常数是指:一定温度下,可逆反应到达平衡时,生成物的浓度系数次幂之积与反应物的浓度系数次幂之积的比,固体、纯液体不需要在化学平衡常数中写出;
由表中数据可知,温度越高平衡常数越大,说明升高温度平衡向正反应移动;
(2)计算此时浓度商Qc,若Qc=K,处于平衡状态,若Qc<K,反应向正反应进行,若Qc>K,反应向逆反应进行,进而判断v(N2)正、v(N2)逆相对大小.
解答 解:(1)正反应气体的物质的量减少,混乱度减小,故△S<0;由于反应物能量高于生成物的能量,反应是放热反应,则△H<0,
故选:C;
(2)二氧化碳是反应物,随反应进行浓度减小,甲醇是生成物,随反应进行浓度增大,10nim内达到平衡,生成甲醇浓度为0.75mol/L,二氧化碳浓度变化了0.75mol/L,则:
CO2(g)+3H2(g)═CH3OH(g)+H2O(g)
起始量(mol/L):1 4 0 0
变化量(mol/L):0.75 2.25 0.75 0.75
平衡量(mol/L):0.25 1.75 0.75 0.75
①则v(CO2)=$\frac{0.75mol}{10min}$=0.075mol/(L•min),故答案为:0.075mol/(L•min);
②氢气的转化率=$\frac{2.25mol/L}{4mol/L}$×100%=56.25%,故答案为:56.25%;
③A.反应是放热反应,升温平衡逆向进行,故A错误;
B.将CH3OH(g)及时液化抽出,减小生成物的量平衡正向进行,故B正确;
C.选择高效催化剂只能改变速率,不改变化学平衡,故C错误;
故选:B;
Ⅱ.(1)CO2(g)+H2(g)?CO(g)+H2O(g)的平衡常数表达式K=$\frac{c(CO)•c({H}_{2}O)}{c(C{O}_{2})•c({H}_{2})}$,
由表中数据可知,温度越高平衡常数越大,说明升高温度平衡向正反应移动,则正反应为吸热反应,
故答案为:$\frac{c(CO)•c({H}_{2}O)}{c(C{O}_{2})•c({H}_{2})}$;吸热;
(2)反应气体气体物质的量不变,可以用物质的量代替浓度计算浓度商,则浓度商Qc=$\frac{0.75×1.5}{1×1.2}$=0.9375<K=1,反应向正反应进行,则v(N2)正>v(N2)逆,
故答案为:>;B.
点评 本题考查化学平衡计算、平衡常数、反应中能量变化等,理解掌握根据浓度商与平衡常数关系判断反应进行方向.

 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案| A. | 将氯水滴入紫色石蕊溶液中,可以看到先变红后褪色 | |
| B. | 将氯水滴入硝酸银溶液,有白色沉淀生成 | |
| C. | 向氯水中滴加碳酸钠溶液,有气体产生 | |
| D. | 向氯水中滴加溴化钾溶液,下层出现橙红色 |
| A. | 加入H+有气体产生的溶液中:SO${\;}_{3}^{2-}$、Ba2+、K+、NO${\;}_{3}^{-}$ | |
| B. | 使酚酞显红色的溶液中:NO${\;}_{3}^{-}$、Cl-、K+、Ba2+ | |
| C. | 加铁粉能放出氢气的溶液中:Na+、H+、CH3COO-、Cl- | |
| D. | 呈酸性的无色溶液中:K+、Fe2+、NO32-、SO42- |
| A. | 与铝粉反应放出氢气的无色溶液中:NO3-、Al3+、Na+、SO42- | |
| B. | 使红色石蕊试纸变蓝的溶液SO42-、HCO3-、Na+、K+ | |
| C. | 中性溶液:Fe3+、Al3+、NO3-、SO42- | |
| D. | 常温下,$\frac{C({H}^{+})}{C(O{H}^{-})}$=10-12的溶液:K+、AlO2-、CO32-、Na+ |
| A. | 用氯气制备漂白粉 | B. | 氯气和铜 | ||
| C. | 氯气和氢气 | D. | 浓盐酸与二氧化锰反应生成氯气 |