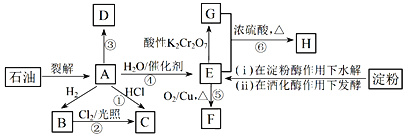
题目内容
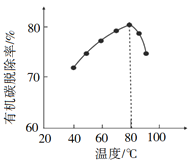
【题目】某温度下,HNO2和CH3COOH的电离常数分別为5.0×10-4和1.7×10-5。将pH和体积均相同的两种酸溶液分别稀释,其pH随加水体积的变化如图所示。下列叙述正确的是
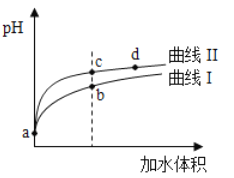
A.曲线I代表HNO2溶液
B.溶液中水的电离程度:b点>c点
C.相同体积a点的两溶液分别与NaOH恰好中和后,溶液中n(Na+)相同
D.从c点到d点,溶液中![]() 保持不变(其中HA、A-分别代表相应的酸和酸根离子)
保持不变(其中HA、A-分别代表相应的酸和酸根离子)
【答案】D
【解析】
根据HNO2和CH3COOH的电离平衡常数,推出HNO2的酸性强于CH3COOH,相同pH、相同体积时,稀释相同倍数,酸性强的pH变化大,即曲线II为HNO2的稀释曲线,曲线I为CH3COOH的稀释曲线,据此分析。
A、根据HNO2和CH3COOH的电离平衡常数,推出HNO2的酸性强于CH3COOH,相同pH、相同体积时,稀释相同倍数,酸性强的pH变化大,即曲线II为HNO2的稀释曲线,曲线I为CH3COOH的稀释曲线,故A错误;
B、b点pH小于c点,说明b点溶液中c(H+)大于c点溶液中c(H+),即溶液水的电离程度:c点大于b点,故B错误;
C、HNO2的酸性强于CH3COOH,相同pH时,c(CH3COOH)>c(HNO2),即等体积、等pH时,与NaOH恰好中和时,CH3COOH消耗NaOH多,则此时,CH3COONa溶液中Na+含量较多,故C错误;
D、![]() ,Kw、Ka只受温度的影响,因此从c点到d点,该比值保持不变,故D正确;
,Kw、Ka只受温度的影响,因此从c点到d点,该比值保持不变,故D正确;
答案选D。

练习册系列答案
 活力课时同步练习册系列答案
活力课时同步练习册系列答案
相关题目