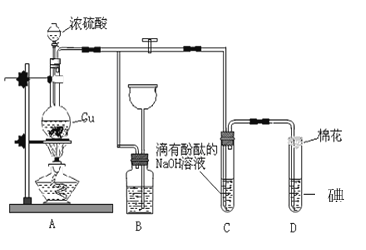
题目内容
【题目】氯碱工厂生产的氯气和氢气可以进一步用于生产盐酸,主要过程如下:

(1)其中关键的一步为氯气和氢气在燃烧管口燃烧生成HCl,氯气有毒,应采取的措施是____。合成盐酸厂要求合成气中的HCl的含量要大于97%,试用最简便的方法进行分析是否含量大于97%____。
(2)氯碱工厂生产的氯气和氢氧化钠溶液可以用于制取“84消毒液”,反应的化学方程式为__。
(3)某同学欲证明盐酸与氯化氢气体性质不同,他分别向A、B、C三支洁净试管中各放入一片干燥的蓝色石蕊试纸,然后往A试管内加入盐酸,试纸显___色,往B试管中通入干燥的氯化氢气体,试纸显___色.最后向C试管中加入物质___(填化学式),他之所以加入这种物质的理由是____。
【答案】先通氢气点燃,再通Cl2 用100mL刻度瓶收集满HCl气体,置于水中,水升至97mL以上即认为符合要求 Cl2+2NaOH=NaCl+NaClO+H2O 红色 蓝色 H2O 证明单独的氯化氢气体或水均不能使蓝色石蕊试纸变色
【解析】
(1)氯气有毒,为保证氯气完全反应,氢气应过量,则应从外管通入氢气,从内管通入氯气,故答案为:先通氢气点燃,再通Cl2;
合成盐酸厂要求合成气中的HCl的含量要大于97%,用100mL刻度瓶收集满HCl气体,置于水中,水升至97mL以上即认为符合要求;
(2)氯碱工厂生产的氯气和氢氧化钠溶液可以用于制取“84消毒液”,氯气与氢氧化钠溶液反应生成氯化钠、次氯酸钠和水,反应的化学方程式为Cl2+2NaOH=NaCl+NaClO+H2O;
(3)盐酸是一种酸,盐酸溶液中的氢离子能使蓝色石蕊试液变成红色,氯化氢既不属于酸也不属于碱,不能能使蓝色石蕊试纸变色,仍为蓝色;
盐酸能使蓝色石蕊试纸变红,盐酸是氯化氢气体的水溶液,氯化氢气体和水能不能使蓝色石蕊试纸变红呢?通过B试管中实验已经排除了单独的氯化氢气体不能使蓝色石蕊试纸变色,还需要进一步排除单独的水也不能使使蓝色石蕊试纸变色,要利用控制变量法向C试管中单独加入水进行试验,水的化学式为H2O。
故答为:红色;蓝色;H2O;证明单独的氯化氢气体或水均不能使蓝色石蕊试纸变色。