题目内容
【题目】某化学兴趣小组为探究铜跟浓硫酸的反应,用如图装置进行有关实验。请回答:
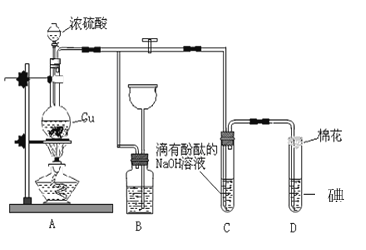
(1)装置A中发生的化学反应的化学方程式: _________________________________。
(2)装置B 的作用是__________________,B中广口瓶内应盛放的液体是_________(填序号)
①水 ②澄清石灰水
③Na2CO3溶液 ④饱和的NaHSO3 溶液
(3)装置C和D 中产生的现象相同,但原因却不同。C中反应的方程式:_______________________________________,而D 中则是由于SO2 具有_______性,D中反应的方程式:________________________。
(4)实验中,0.1molCu与含0.2mol硫酸的溶液反应后,铜和硫酸都有剩余。 可以证明有余酸的实验方案是___________
A.可再加入锌粒 B.可再加入氯化钡溶液
C.再加入银粉 D.再滴入碳酸氢钠溶液
【答案】Cu + 2H2SO4 ![]() CuSO4 + SO2 + 2H2O 贮存多余的气体 ④ NaOH + SO2 → NaHSO3 还原 SO2 + I2 + 2H2O → H2SO4 + 2HI A D
CuSO4 + SO2 + 2H2O 贮存多余的气体 ④ NaOH + SO2 → NaHSO3 还原 SO2 + I2 + 2H2O → H2SO4 + 2HI A D
【解析】
浓硫酸具有强氧化性,在加热条件下与铜发生氧化还原反应: ![]() ,反应生成的二氧化硫具有酸性和还原性,可用排饱和亚硫酸氢钠溶液收集,具有漂白性,可使品红溶液褪色,随着反应的进行,硫酸浓度不断降低,稀硫酸与铜不反应。
,反应生成的二氧化硫具有酸性和还原性,可用排饱和亚硫酸氢钠溶液收集,具有漂白性,可使品红溶液褪色,随着反应的进行,硫酸浓度不断降低,稀硫酸与铜不反应。
(1)浓硫酸具有强氧化性,在加热条件下与铜发生氧化还原反应生成硫酸铜、二氧化硫和水,Cu + 2H2SO4 ![]() CuSO4 + SO2 + 2H2O;
CuSO4 + SO2 + 2H2O;
(2)装置B的作用是贮存多余气体,二氧化硫易溶于水,具有酸性和还原性,可与酸性高锰酸钾、亚硫酸钠溶液反应,难溶于水饱和的NaHSO3溶液,可用排饱和NaHSO3溶液收集,;
(3)二氧化硫溶液具有酸性,可与NaOH溶液反应,发生: ![]() ,则滴加酚酞的氢氧化钠溶液褪色,具有漂白性,可使品红溶液褪色,;
,则滴加酚酞的氢氧化钠溶液褪色,具有漂白性,可使品红溶液褪色,;
(4)证明酸有剩余,只需证明有多余的氢离子即可,故可加入活泼金属或者碳酸盐,答案选AD。

 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案