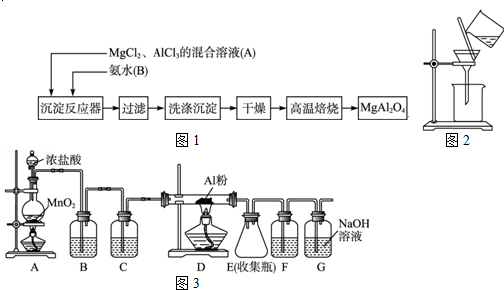
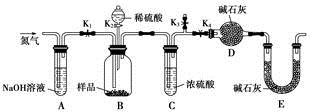
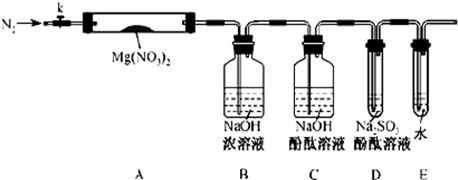
题目内容
牙膏中的摩擦剂一般由CaCO3、Al(OH)3或SiO2组成。某小组对几种牙膏中摩擦剂成分及其含量进行探究:
(1)根据上述信息,推测摩擦剂应具备的性质有
A.易溶于水 B.难溶于水 C.颗粒较大 D.颗粒较小
(2)已知A牌牙膏的摩擦剂是Al(OH)3,取少量牙膏样品,加水充分搅拌、过滤:
①往滤渣中加入过量NaOH溶液,Al(OH)3与NaOH溶液反应的离子方程式____ __。
②往①所得滤液先通入过量CO2,再加入过量稀盐酸,观察到的现象是 。
(3)已知B牌牙膏中摩擦剂可能含有一或两种物质,将此牙膏的摩擦剂溶于盐酸时,发现有不溶性物质。
① 对B品牌牙膏摩擦剂的成分提出合理假设:
假设1:只有SiO2 假设2:可能有SiO2和CaCO3
假设3:可能有________________。
② 请设计方案对B品牌牙膏摩擦剂的成分进行验证。填写下表。限选试剂:稀盐酸、稀硫酸、NaOH溶液、澄清石灰水
| 实验步骤 | 预期现象和结论 |
| 步骤1:取适量牙膏样品,加水成分搅拌、过滤,得滤液A和沉淀B。 | |
| 步骤2: | |
| 步骤3: | |
(1)B D(3分,选1个对的得1分,全对3分)
(2)① Al(OH)3+OH-=AlO2-+2H2O(3分,未配平扣1分)(或Al(OH)3+OH-=[Al(OH)4]- )
②通入CO2气体有白色沉淀生成;加入盐酸有气体生成、沉淀溶解;(2分)(或:通入CO2气体有白色沉淀生成;加入盐酸沉淀溶解)
(3)①SiO2和Al(OH)3(或二氧化硅和氢氧化铝)(1分,少一种不得分)
②(4分)实验步骤 预期现象和结论 步骤2:取适量沉淀B于试管中,滴加过量稀盐酸(1分) 出现无色气泡,说明含有碳酸钙(1分) 步骤3:取步骤2的上层清液,滴加氢氧化钠溶液(1分) 先生成沉淀,后沉淀溶解,说明含有氢氧化铝。(1分)
(4)18.75% (或0.1875)( 3分)
解析试题分析:(1)牙膏中的摩擦剂一般由CaCO3、Al(OH)3或SiO2组成,根据这几种物质的特点都难溶于水,推测用于刷牙的固体颗粒不会太大,所以答案选BD。
(2)①Al(OH)3难溶于水,书写离子方程式时不能拆开,所以Al(OH)3与NaOH溶液反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O;
②往①所得滤液先通入过量CO2,二氧化碳与偏铝酸钠反应生成氢氧化铝沉淀,所以会看到有白色沉淀生成;再加入过量稀盐酸,稀盐酸和氢氧化铝发生中和反应,沉淀消失,同时溶液中的碳酸氢根离子与氢离子反应生成二氧化碳气体;
(3)①此牙膏的摩擦剂溶于盐酸时,发现有不溶性物质。说明一定含二氧化硅,3种物质中选择一种或2种其中必有二氧化硅的可能有3种,所以假设3应是可能有SiO2和Al(OH)3
②步骤1后得沉淀B,取适量B于试管中,加入稀盐酸,若固体不溶解,则为假设1;若固体部分溶解且有气体产生则为假设2;若固体部分溶解且无气体产生则为假设3。
或者取适量B于试管中,加入稀盐酸,有气体产生,证明有碳酸钙;取以上反应的清液,加入氢氧化钠溶液,先生成沉淀,后沉淀溶解,说明含有氢氧化铝。
(4)由消耗氢氧化钠的体积可计算100mL的溶液中剩余H+的物质的量是5×10-3L×1mol/L×5=0.025mol,则用于和碳酸钙反应的H+的物质的量是0.1L×1mol/L-0.025mol=0.075mol,由2H+~CaCO3得碳酸钙的物质的量是0.0375mol,所以样品中碳酸钙的质量是3.75g,则碳酸钙的质量分数是3.75g/20.0g×100%=18.75%。
考点:考查对实验的分析、设计、判断能力

 阅读快车系列答案
阅读快车系列答案乙酰乙酸乙酯(CH3COCH2COOC2H5)是一种不溶于水的液体,熔点:-45 °C,沸点:180.8℃,它是有机合成中常用的原料。在实验室,它可以由乙酸乙酯在乙醇钠的催化作用下缩合而制得,反应式为:2CH3COOC2H5 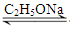 CH3COCH2COOC2H5+C2H5OH。反应中催化剂乙醇钠是由金属钠和残留在乙酸乙酯中的微量乙醇作用生成的,而一旦反应开始,生成的乙醇又会继续和钠反应生成乙醇钠。乙酰乙酸乙酯制备的流程如下:
CH3COCH2COOC2H5+C2H5OH。反应中催化剂乙醇钠是由金属钠和残留在乙酸乙酯中的微量乙醇作用生成的,而一旦反应开始,生成的乙醇又会继续和钠反应生成乙醇钠。乙酰乙酸乙酯制备的流程如下: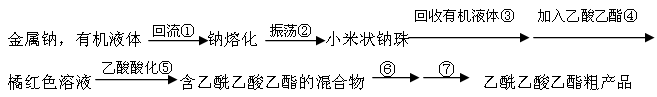
阅读下面关于乙酰乙酸乙酯制备的实验过程,并回答有关问题。
(1)将适量干净的金属钠放入烧瓶中,为了得到小米状的钠珠,需将钠熔化,为了防止钠的氧化,熔化时需在钠上覆盖一层有机液体,下表是钠和一些常用有机液体的物理性质:
| | 钠 | 苯 | 甲苯 | 对二甲苯 | 四氯化碳 |
| 密度(g/cm3) | 0.97 | 0.88 | 0.87 | 0.86 | 1.60 |
| 熔点(℃) | 97.8 | 5.5 | -95 | 13.3 | -22.8 |
| 沸点(℃) | 881.4 | 80 | 111 | 138. 4 | 76.8 |
最好选用 来熔化钠。是否能用四氯化碳? (填“是”或“否”)理由是 。
(2)将烧瓶中的有机液体小心倾出,迅速加入适量乙酸乙酯,装上带有一根长玻璃导管的单孔胶塞,并在导管上端接一个干燥管。缓缓加热,保持瓶中混合液微沸状态。在实验中,使用烧瓶必须干燥,原料乙酸乙酯必须无水,原因是 。烧瓶配上长导管的作用是 ,导管上端接一干燥管的目的是 。
(3)步骤⑥为向混合溶液中加入饱和食盐水,其目的是 ,写出步骤⑦实验操作的主要仪器 (填最主要一种)。
粗产品(含乙酸乙酯和少量水及乙酸等)经过几步操作,最后成为纯品。
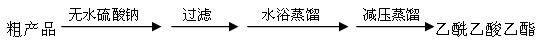
(4)向分离出的乙酰乙酸乙酯粗产品中加无水硫酸钠固体的作用是 。
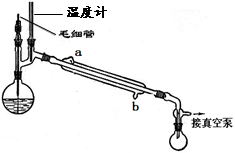
(5)精馏乙酰乙酸乙酯时需要减压蒸馏,装置如图所示。冷凝管的进出水方向应 口进, 口出。毛细管的作用是 。
某化学小组以苯甲酸为原料制取苯甲酸甲酯。有关物质的沸点和相对分子质量如表:
| 物质 | 甲醇 | 苯甲酸 | 苯甲酸甲酯 |
| 沸点/℃ | 64.7 | 249 | 199.6 |
| 相对分子质量 | 32 | 122 | 136 |
Ⅰ.合成苯甲酸甲酯粗产品
在烧瓶中加入12.2g苯甲酸和20mL 甲醇(密度约0.79g/mL) ,再小心加入3mL 浓硫酸,混匀后,投入几粒碎瓷片,小心加热使反应完全,得苯甲酸甲酯粗产品。
(1)该反应中浓硫酸的作用 ,若反应产物水分子中有同位素18O,写出能表示反应前后18O位置的化学方程式: ,甲醇过量的原因 。
(2)如果加热一段时间后发现忘记加碎瓷片,应该采取的正确操作是 。
(3)甲、乙、丙三位同学分别设计了如图三套实验室制取苯甲酸甲酯的装置(夹持仪器和加热仪器均已略去)。根据有机物的特点,最好采用 装置(填“甲”、“乙”、“丙”)。
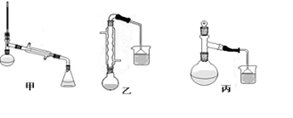
Ⅱ.粗产品的精制
(4)苯甲酸甲酯粗产品中往往含有少量甲醇、硫酸、苯甲酸和水等,现拟用下列流程图进行精制,请根据流程图填入恰当操作方法的名称:操作I为 ,操作II为 。
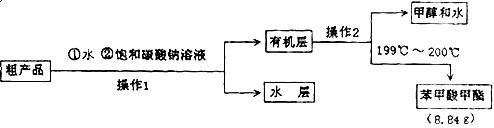
(5)以上流程图中加入Na2CO3溶液后,放入分液漏斗中振荡、静置,要得到有机层,其具体操作是 。
(6)苯甲酸甲酯的产率为 。
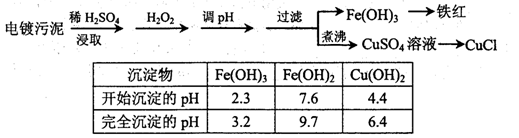
 Fe(OH)3+3H+,该反应的平衡常数为 。
Fe(OH)3+3H+,该反应的平衡常数为 。