题目内容
在密闭容器中发生反应:4NH3(g)+5O2(g) 4NO(g)+6H2O(g) △H<0,下列措施能使平衡正向移动的是
4NO(g)+6H2O(g) △H<0,下列措施能使平衡正向移动的是
| A.增大压强 | B.升高温度 | C.加入催化剂 | D.增大O2的浓度 |
D
解析试题分析:A、该反应是体积增大的可逆反应,增大压强,平衡向逆反应方向移动,A不正确;B、正方应是放热反应,升高温度平衡向逆反应方向移动,B不正确;C、催化剂只能改变反应速率,不能改变平衡状态,C不正确;D、增大氧气的浓度,即增大反应物浓度,平衡向正反应方向移动,D正确,答案选D。
考点:考查外界条件对平衡状态的影响

 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案20 ℃ 时,将0.1 mol/L Na2S2O3溶液10mL 和 0.1 mol/L H2SO4溶液10mL混合,2 min 后溶液出现明显浑浊(发生的反应为Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+H2O)。已知温度每升高10 ℃ ,该反应的化学反应速率增大到原来的2倍。那么50 ℃时,同样的反应要明显地出现浑浊,所需时间是
| A.48s | B.40s | C.20s | D.15s |
在一定温度下的定容密闭容器中,当物质的下列物理量不再变化时,不能说明反应
A(s)+2B(g) C(g)+D(g)已达平衡状态的是
C(g)+D(g)已达平衡状态的是
| A.混合气体的压强 | B.混合气体的密度 |
| C.B的物质的量浓度 | D.气体的平均相对分子质量 |
工业上可利用合成气(CO和H2的混合气体)生产甲醇。已知:
CO(g)+2H2(g) CH3OH(g) ΔH=—92.9kJ/mo1
CH3OH(g) ΔH=—92.9kJ/mo1
一定条件下,该反应在一体积固定的密闭容器中达到平衡。下列说法正确的是
| A.该反应的△S<0 |
| B.该反应在任何温度下均能自发进行 |
| C.向容器中充入少量He,平衡向正反应方向移动 |
| D.升高温度平衡向正反应方向移动 |
汽车上的催化转化器可将尾气中的主要污染物转化成无毒物质,反应为:
2NO(g)+2CO(g) N2(g)+2CO2(g) DH=-a kJ/mol(a>0)
N2(g)+2CO2(g) DH=-a kJ/mol(a>0)
在某温度时,用气体传感器测得不同时间的NO和CO浓度如下表:
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/10-4 mol·L-1 | 10.0 | 4.05 | 2.50 | 1.60 | 1.00 | 1.00 |
| c(CO)/10-3 mol·L-1 | 3.60 | 3.05 | 2.85 | 2.76 | 2.70 | 2.70 |
经分析,得出结论不正确的是
A.2~3 s间的平均反应速率v(NO)=9×10-5 mol/(L·s)
B.催化转化器对废气的转化速率在夏季时比冬季时高
C.若该催化转化器气舱容积为2 L,则达到平衡时反应放出热量1.8a J
D.该温度下,此反应的平衡常数K=5000
某恒温密闭容器发生可逆反应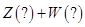
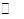
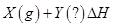 ,在
,在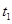 时刻反应达到平衡,在
时刻反应达到平衡,在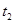 时刻缩小容器体积,
时刻缩小容器体积, 时刻再次达到平衡状态后未再改变条件。下列有关说法中正确的是
时刻再次达到平衡状态后未再改变条件。下列有关说法中正确的是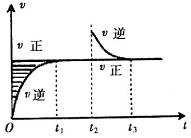
| A.Z和W在该条件下至少有一个是为气态 |
B.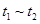 时间段与 时间段与 时刻后,两时间段反应体系中气体的平均摩尔质量不可能相等 时刻后,两时间段反应体系中气体的平均摩尔质量不可能相等 |
C.若在该温度下此反应平衡常数表达式为K=c(X),则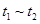 时间段与 时间段与 时刻后的X浓度不相等 时刻后的X浓度不相等 |
D.若该反应只在某温度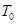 以上自发进行,则该反应的平衡常K随温度升高而增大 以上自发进行,则该反应的平衡常K随温度升高而增大 |
相同容积的四个密闭容器中进行同样的可逆反应:2X(g)+Y(g) 3W(g)+2Z(g)起始时四个容器所装X、Y的量分别为:甲(X:2mol,Y:1mol) 乙(X:1mol,Y:1mol)丙(X:2mol,Y:2mol) 丁(X:1mol,Y:2mol)在相同温度下,建立平衡时,X或Y的转化率大小关系为
3W(g)+2Z(g)起始时四个容器所装X、Y的量分别为:甲(X:2mol,Y:1mol) 乙(X:1mol,Y:1mol)丙(X:2mol,Y:2mol) 丁(X:1mol,Y:2mol)在相同温度下,建立平衡时,X或Y的转化率大小关系为
| A.X的转化率为:甲<丙<乙<丁 |
| B.X的转化率为:甲<乙<丙<丁 |
| C.Y的转化率为:甲>丙>乙>丁 |
| D.Y的转化率为:丁>乙>丙>甲 |
 2C(g)若经 2 s(秒)后测得 C 的浓度为 0.6 mol·L-1 ,现有下列几种说法:
2C(g)若经 2 s(秒)后测得 C 的浓度为 0.6 mol·L-1 ,现有下列几种说法: