题目内容
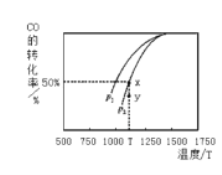
【题目】(1)可逆反应A(g)+B(g)2C(g)在不同温度下经过一定时间,混合物中C的体积分数与温度的关系如图所示.

①由T1向T2变化时,正反应速率________逆反应速率(填“>”、“<”或“=”).
②由T3向T4变化时,正反应速率________逆反应速率(填“>”、“<”或“=”).
③反应在________温度下达到平衡.
④此反应的正反应为________热反应.
(2)800℃时,在2L密闭容器中发生反应2NO(g)+O2(g)2NO2(g),在反应体系中,n(NO)随时间的变化如表所示:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
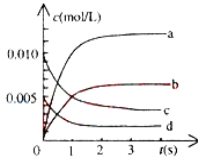
①图中表示NO2变化的曲线是________ ,用O2表示从0~2s内该反应的平均速率v=________ .
②能说明该反应已经达到平衡状态的是________
a.v(NO2)=2v(O2)
b.容器内压强保持不变
c.v逆(NO)=2v正(O2)
d.容器内的密度保持不变.
【答案】><T3放b0.0015mol/(Ls)bc
【解析】
① T3之前,反应没有达到平衡状态,反应正向进行,正反应速率大于逆反应速率,因此,本题正确答案是: > 。
② T3后随温度升高,平衡逆向移动,逆反应速率大于正反应速率;因此,本题正确答案是: <。
③ T3之前,反应没有达到平衡状态, T3时反应达到平衡状态;因此,本题正确答案是: T3。
④ T3后随温度升高,平衡逆向移动,说明正反应放热;因此,本题正确答案是:放。
(2)①从图象分析,随反应时间的延长,各物质的浓度不再不变,且反应物没有完全反应,所以反应为可逆反应,根据一氧化氮物质的量的变化知,该反应向正反应方向移动,则二氧化氮的物质的量在不断增大,且同一时间段内,一氧化氮减少的物质的量等于二氧化氮增加的物质的量,所以表示NO2的变化的曲线是b, 0~2s内v(NO)=(0.02-0.008)/(2×2)=0.0030 mol/(Ls),同一化学反应同一时间段内,各物质的反应速率之比等于其计量数之比,所以氧气的反应速率为0.0015mol/(Ls),因此,本题正确答案是:b,0.0015mol/(Ls)。
②a.反应速率之比等于化学方程式计量数之比, v(NO2)=2v(O2),没有指明正逆反应速率,无法判断正逆反应速率是否相等,故a错误;
b.反应前后气体体积不同,压强不变说明正逆反应速率相等,各组分浓度不变,可以说明该反应已经达到平衡状态,故b正确;
c.反应速率之比等于化学方程式计量数之比v逆(NO)=2v正(O2),一氧化氮正逆反应速率相同,说明反应达到平衡状态,故c正确;
d.恒容容器,反应物、生成物都是气体,质量不变,体积不变,所以密度始终不变,不能说明反应达到平衡状态,故d错误;bc符合题意;
综上所述,本题选bc。

【题目】一定条件下,H2O2在水溶液中发生分解反应:2H2O2![]() 2H2O+O2↑反应过程中,测得不同时间H2O2的物质的量浓度如下表:
2H2O+O2↑反应过程中,测得不同时间H2O2的物质的量浓度如下表:
t/min | 0 | 20 | 40 | 60 | 80 |
c(H2O2)/molL﹣1 | 0.80 | 0.40 | 0.20 | 0.10 | 0.05 |
① H2O2的分解反应________氧化还原反应(填“是”或“不是”).
②该分解反应0─20min的平均反应速率v(H2O2)为________molL﹣1 min﹣1 .
③如果反应所用的H2O2溶液为100mL,则共产生O2________g.
A.0.08 B.0.16 C.1.28 D.2.4.