题目内容
19.绿色化学是“预防污染”的根本手段,它的目标是研究和寻找能充分利用的无毒害原材料,最大限度地节约能源,在化工生产各个环节中都实现净化和无污染.(1)下列各项符合“绿色化学”要求的是D.
A.处理废弃物 B.治理污染点
C.减少有毒物 D.杜绝污染源
(2)在我国西部大开发中,某地为筹建一大型化工基地,征集到下列方案,其中你认为可行的是BD.
A.建在西部干旱区可以脱贫致富
B.应建在水资源丰富和交通方便且远离城市的郊区
C.企业有权自主选择厂址
D.不宜建在人口稠密的居民区
(3)某化工厂排放的污水中含有Mg2+、Fe3+、Cu2+、Hg2+四种离子.某同学设计了从该污水中回收纯净的金属铜的方案.

在能制得纯铜的方案中,哪一步操作会导致环境污染?第③步.应增加哪些措施防止污染增加冷凝回收装置.
分析 (1)绿色化学要求从根本上减少或者杜绝污染源,据此解答;
(2)根据大型化工企业的特点需要大量的水源,进出货物需方便即交通运输方便,还有可能污染环境,所以要远离居民区;
(3)丙方案中的第③步由于汞的沸点低、易挥发、有毒,因此会导致环境污染;
解答 解:(1)依据绿色化学的含义可知:绿色化学要求从根本上减少或者杜绝污染源,
故答案为:D;
(2)A.建在干旱山区缺乏水分不利于化工企业的运作,故A错误;
B.大型化工企业必须水源充足,交通方便,故B正确;
C.不能乱选择基地,必须保证水源充足,交通方便,不能污染居民,故C错误;
D.由于大型化工企业具有污染性,不能建在居民区附近,故D正确;
故选BD;
(3)丙方案中:铁的活泼性强于铜和汞,能够置换铜、汞,所以污水中加入过量的铁粉后得滤渣的成分主要是铜、汞和剩余的铁,滤渣中铜汞不能与与盐酸反应,而铁能反应,此时滤渣就变成了铜与汞的混合物,加热汞转化成汞蒸气挥发出来,铜与氧气反应生成了氧化铜,氧化铜采用氢气还原可得纯净的铜;从该过程可以看出该步骤中③是汞的污染环节,要想防止汞污染的产生就得需要对汞蒸气进行处理,以防止汞蒸气挥发到空气中导致污染,
故答案为:丙方案的第③步;增加冷凝回收装置;
点评 本题考查了环境污染与治理,熟悉绿色化学的内涵及实验流程是解题关键,注意实验设计的目的,题目难度中等.

练习册系列答案
 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案
相关题目
7.设NA为阿伏加德罗常数的值.下列叙述不正确的是( )
| A. | 用丙烷和水蒸气高温下反应制取氢气,每产生0.3molCO,同时产生0.7NA个H2分子 | |
| B. | 常温常压下,16 g O3所含的电子数为8NA | |
| C. | 标准状况下 11.2 L NO与11.2 L O2混合,充分反应后所含分子数小于0.75NA | |
| D. | 1 mol/L的Ca(ClO)2溶液中含ClO-数目一定小于2NA |
14. 下图为根据电解原理制成“银电量计”.其原理是:通过测定电解过程中附着在惰性电极上金属质量,计算通过电解池的电量.下列说法正确的是( )
下图为根据电解原理制成“银电量计”.其原理是:通过测定电解过程中附着在惰性电极上金属质量,计算通过电解池的电量.下列说法正确的是( )
 下图为根据电解原理制成“银电量计”.其原理是:通过测定电解过程中附着在惰性电极上金属质量,计算通过电解池的电量.下列说法正确的是( )
下图为根据电解原理制成“银电量计”.其原理是:通过测定电解过程中附着在惰性电极上金属质量,计算通过电解池的电量.下列说法正确的是( )| A. | 电量计工作时溶液里的阴离子向正极移动 | |
| B. | 电量计工作时银棒应与电源的正极相连 | |
| C. | 网袋是收集银溶解过程中产生的金属颗粒,若没有该网袋,测量结果会偏低 | |
| D. | 若得金属银的沉积量为1.08g,则电解过程中转移的电子为0.01mol |
4.下列有关物质性质与应用对应关系正确的是( )
| A. | 炭具有还原性,一定条件下能将二氧化硅还原为硅 | |
| B. | 二氧化硫具有还原性,能用于漂白纸浆 | |
| C. | 碳酸钠能和酸反应,常用于治疗胃酸过多 | |
| D. | 氧化铝熔点很高,用其制造的坩埚可用于熔融烧碱 |
3.被称为“智慧元素”--碘的单质及其化合物应用十分广泛,碘化钠常用于医疗和照相业等.某实验小组模拟其工业制备工艺流程如图1:

请回答下列问题:
(1)操作A包括加热浓缩、冷却结晶、过滤;用冰水洗涤的目的是洗涤除去表面可溶性杂质,同时尽量减少NaI的溶解损失;反应②的离子方程式为2Fe+IO3-+3H2O═2Fe(OH)3+I-.
(2)某同学推测得到的成品除含有NaI外,还可能有NaIO3和NaOH,并设计如下方案进行检验,实验结果表明其推测正确.
已知:IO3-+5I-+6H+=3I2+3H2O2;NaIO3水溶液呈中性.
限选试剂:1mol•L-1H2SO4溶液、2mol•L-1HNO3溶液、淀粉溶液、酚酞试液、石蕊试液、蒸馏水.其它仪器和用品自选.
(3)如图2装置Ⅰ为一种可充电电池的示意图,其中的离子交换膜只允许Na+通过,该电池充、放电的化学方程式为Na2S4+3NaI$?_{放电}^{充电}$2Na2S2+NaI3,装置Ⅱ为电解池的示意图.当闭合开关S时,电极X附近溶液先变红.此时,电极B上发生反应的电极反应式为NaI3+2Na++2e-=3NaI.电极Y上发生氧化(填“氧化”、“还原”)反应.装置Ⅱ溶液的体积为100mL,电解结束后若X极生成1.12L(已换算成标准状况)气体,则此时溶液的pH=14(假设溶液体积没有变化).

请回答下列问题:
(1)操作A包括加热浓缩、冷却结晶、过滤;用冰水洗涤的目的是洗涤除去表面可溶性杂质,同时尽量减少NaI的溶解损失;反应②的离子方程式为2Fe+IO3-+3H2O═2Fe(OH)3+I-.
(2)某同学推测得到的成品除含有NaI外,还可能有NaIO3和NaOH,并设计如下方案进行检验,实验结果表明其推测正确.
已知:IO3-+5I-+6H+=3I2+3H2O2;NaIO3水溶液呈中性.
限选试剂:1mol•L-1H2SO4溶液、2mol•L-1HNO3溶液、淀粉溶液、酚酞试液、石蕊试液、蒸馏水.其它仪器和用品自选.
| 实验方案 | 实验现象 | 结论 |
| 将白色晶体溶于水,并滴2滴淀粉溶液 | 得到无色溶液 | |
| 取少量溶液于试管A中,加入足量的1mol•L-1H2SO4 | 溶液呈蓝色 | 溶液中含IO3- |
| 另取少量溶液于试管B中,滴入几滴酚酞溶液 | 溶液变红 | 溶液中含大量OH- |
4.下列解释事实的方程式不准确的是( )
| A. | NH4HCO3溶于过量的浓KOH溶液中:NH4++HCO3-+2OH-=CO32-+NH3↑+2 H2O | |
| B. | 用浓盐酸检验氨:NH3+HCl=NH4Cl | |
| C. | 钢铁发生吸氧腐蚀时,铁作负极被氧化:Fe-3e-=Fe3+ | |
| D. | 用铜做电极电解CuSO4溶液:2Cu2++2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+4H+ |
 ;试比较稳定性:KClO3<乙(填“>”、“<”或“=”).
;试比较稳定性:KClO3<乙(填“>”、“<”或“=”).
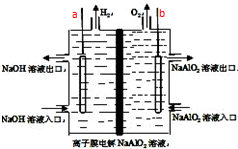 工业上利用离子膜电解偏铝酸钠溶液制备高品质的氢氧化铝,装置如图所示(a、b为电源的电极):该电池的总反应方程式为:4NaAlO2+10H2O$\frac{\underline{\;通电\;}}{\;}$ 4Al(OH)3↓+4NaOH+O2↑+2H2↑.电解池阳极室发生的电极反应式是4AlO2-+6H2O-4e-=4Al(OH)3↓+O2↑,该离子膜为阳离子交换膜(填“阴”或“阳”)
工业上利用离子膜电解偏铝酸钠溶液制备高品质的氢氧化铝,装置如图所示(a、b为电源的电极):该电池的总反应方程式为:4NaAlO2+10H2O$\frac{\underline{\;通电\;}}{\;}$ 4Al(OH)3↓+4NaOH+O2↑+2H2↑.电解池阳极室发生的电极反应式是4AlO2-+6H2O-4e-=4Al(OH)3↓+O2↑,该离子膜为阳离子交换膜(填“阴”或“阳”)