题目内容
【题目】VA族元素氮、磷、砷(As)、锑(Sb)、铋(Bi)的单质及其化合物在科研和生产中有许多重要用途。
(1)铋合金可用于自动喷水器的安全塞,一旦发生火灾时,安全塞会“自动”熔化,喷出水来灭火。铋的价电子排布式为_______。
(2)第三周期元素中第一电离能大于磷的元素有_______(填元素符号)。
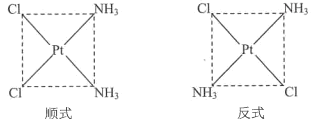
(3)Pt(NH3)2C12具有如图所示的两种平面四边形结构(一种有抗癌作用),其中在水中的溶解度较小是_______(填“顺式”或“反式”)。
(4)氨硼烷(BH3NH3)是一种储氢材料,与乙烷互为等电子体,熔点为104℃。氨硼烷晶体中各种微粒间的作用力涉及________(填标号)。
A.范德华力 B.离子键 C.配位键 D.金属键
(5)偏亚砷酸钠(NaAsO2)是一种灭生性除草剂,可杀死各种草本植物,其阴离子的立体构型为___。
(6)化肥厂生产的(NH4)2SO4中往往含有少量极易被植物根系吸收的具有正四面体结构的N4H44+,其结构式为_______,其中N原子的杂化方式为________。
(7)镧、铁、锑三种元素组成的一种固体能实现热电效应。该固体晶胞结构如图l所示,晶胞参数为a nm,Fe原子填在6个Sb原子形成的正八面体空隙中,晶胞6个表面的结构都如图2所示。
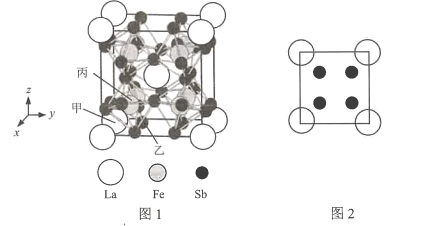
①以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图l中原子甲的坐标为(0,0,0),原子乙的坐标为(![]() ,
,![]() ,0),则原子丙的坐标为________。
,0),则原子丙的坐标为________。
②设阿伏加德罗常数的值为NA,则该固体的密度ρ=__g·cm-3(列出计算式即可)。
【答案】6s26p3 Ar、Cl 反式 AC V形(或角形、折线形) 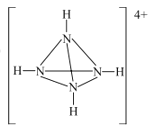 sp3 (
sp3 (![]() ,
,![]() ,
,![]() )
) ![]()
【解析】
(1)第VA的元素最外层有5个电子,根据构造原理可得其价层电子排布式;
(2)根据同一周期的元素,原子序数越大,元素的电离能越大分析(第IIA、VIA反常);
(3)H2O是由极性分子构成的物质,根据相似相溶原理分析;
(4)氨硼烷属于分子晶体,根据分子内元素的原子结构特点及分子之间的作用力分析;
(5)根据价层电子对数及孤电子对数分析判断;
(6)根据N4H44+具有正四面体结构,结合N、H原子个数比书写其结构式;根据该微粒中N原子结合其它原子数目确定其杂化轨道类型;
(7)①根据图示可知丙原子在体对角线的![]() 处,根据已知原子的坐标可确定丙原子的坐标;
处,根据已知原子的坐标可确定丙原子的坐标;
②利用均摊方法计算一个晶胞中含有的各种元素的原子个数,然后根据密度ρ=![]() 计算。
计算。
(1)铋是第六周期第VA的元素,价电子排布式为6s26p3;
(2)一般情况下同一周期的元素,原子序数越大,元素的第一电离能也越大,但第VA的元素由于其处于p轨道的半充满的稳定状态,其第一电离能大于同周期相邻元素,第一电离能P>S,故第三周期元素中第一电离能大于磷的元素有Cl、Ar;
(3)H2O是由极性分子构成的物质,根据相似相溶原理:由极性分子构成的溶质易溶于由极性分子构成的溶剂中。由图示可知Pt(NH3)2C12的顺式结构的极性大于反式结构的极性,所以它在水中溶解度:顺式大于反式,即反式的Pt(NH3)2C12在水中溶解度比较小;
(4)氨硼烷属于分子晶体,分子之间以范德华力结合,在分子内N、H原子间及B、H原子间以共价键结合,B、N原子之间以配位键结合,其中N提供孤对电子,B原子提供空轨道,故合理选项是AC;
(5)偏亚砷酸钠(NaAsO2)的阴离子是AsO2-,其中As原子的孤电子对数为![]() =1,价层电子对数为1+2=3,所以As原子采用sp2杂化,所以AsO2-的立体构型为V形;
=1,价层电子对数为1+2=3,所以As原子采用sp2杂化,所以AsO2-的立体构型为V形;
(6)N4H44+具有正四面体结构,由于N、H原子个数比是1:1,则其结构式为 ;根据微粒结构可知N原子最外层的1个s轨道和3个p轨道全部参与成键,形成了四个共价键,故其杂化轨道类型为sp3杂化;
;根据微粒结构可知N原子最外层的1个s轨道和3个p轨道全部参与成键,形成了四个共价键,故其杂化轨道类型为sp3杂化;
(7)①根据图示可知:丙原子在体对角线的![]() 处,由于甲原子坐标为(0,0,0),乙原子坐标为(
处,由于甲原子坐标为(0,0,0),乙原子坐标为(![]() ,
,![]() ,0)可知丙原子的坐标为(
,0)可知丙原子的坐标为(![]() ,
,![]() ,
,![]() );
);
②根据晶胞结构可知,在一个晶胞中含有的La:8×![]() +1=2;含有Fe:8×1=8;含Sb:24×
+1=2;含有Fe:8×1=8;含Sb:24×![]() +(3×8)×
+(3×8)×![]() =24,晶胞边长L=a nm=a×10-7 cm,所以该固体的密度ρ=
=24,晶胞边长L=a nm=a×10-7 cm,所以该固体的密度ρ=![]() =
=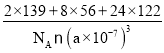 g/cm3=
g/cm3=![]() g/cm3。
g/cm3。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案【题目】下列实验方案能达到相应实验目的的是( )
选项 | 实验目的 | 实验方案 |
A | 检验溴乙烷中的溴原子 | 加入 |
B | 检验溴乙烷发生了消去反应 | 加 |
C | 除去溴苯中的溴 | 用 |
D | 确定乙醇分子的结构 | 通过质谱仪进行质谱分析 |
A.AB.BC.CD.D