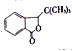
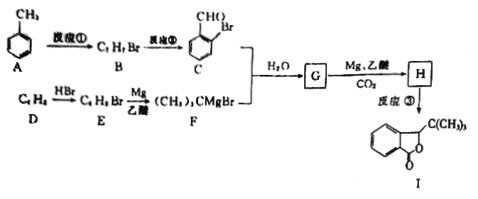
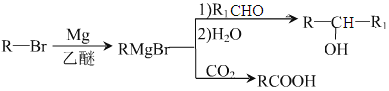
题目内容
【题目】短周期元素R、T、X、Y、Z在元素周期表的相对位置如下表所示,它们的最外层电子数之和为24。则下列判断正确的是

A. R位于元素周期表中第二周期第VA族
B. R能分别与X、Z形成共价化合物
C. 原子半径大小顺序为X > T > Y
D. Z元素的最高价氧化物对应的水化的化学式为HZO4
【答案】B
【解析】R、T、X、Y、Z在元素周期表的相对位置及它们的最外层电子数之和为24,可知R、T、X、Y、Z分别是C、N、Si、P、S;C元素位于元素周期表中第二周期第ⅣA族,故A错误;C能分别与Si、S形成SiC、CS2等共价化合物,故B正确;原子半径大小顺序为Si > P > N,故C错误;S元素的最高价氧化物对应的水化的化学式为H2SO4,故D错误。

练习册系列答案
相关题目
【题目】在3个2 L的密闭容器中,在相同的温度下、使用相同的催化剂分别进行反应:
3H2(g)+N2(g) ![]() 2NH3(g)。按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时有关数据如下表。下列叙述正确的是
2NH3(g)。按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时有关数据如下表。下列叙述正确的是
容器编号 | 起始反应物 | 达到平衡的时间(min) | 平衡时N2的浓度(mol/L) | 平衡时气体密度 |
甲 | 3molH2、2molN2 | t1 | c1 | ρ1 |
乙 | 6molH2、4molN2 | 5 | 1.5 | ρ2 |
丙 | 2molNH3 | 8 | c3 | ρ3 |
A. 2ρ1=ρ2>ρ3
B. 容器乙中反应从开始到达平衡的反应速率为v(H2)=0.05mol/(L·min)
C. c1<c3
D. 2c1<1.5