题目内容
高温下,某反应达平衡,化学平衡常数表达式为: ,恒容时,温度升高H2浓度减小。下列说法正确的是
,恒容时,温度升高H2浓度减小。下列说法正确的是
A.该反应化学方程式为:CO(g)+H2O(g)  CO2(g)+H2(g) CO2(g)+H2(g) |
| B.恒温恒容下,反应达平衡时,再通入一定量的CO2,CO的体积分数一定增大 |
| C.升高温度,正反应速率增大,逆反应速率减小 |
| D.该反应的焓变为正值 |
D
解析试题分析:A.化学平衡常数是可逆反应达到化学平衡状态时各种生成物浓度幂指数的乘积与各种反应物浓度幂指数乘积的比。由化学平衡常数表达式为: 可知该反应的方程式为CO2(g)+H2(g)
可知该反应的方程式为CO2(g)+H2(g)  CO(g)+H2O(g)。错误。B.在恒温恒容下,当反应达平衡时,若再通入一定量的CO2,由于增大了反应物的浓度,所以化学平衡正向移动,CO的物质的量增大,但由于平衡移动的趋势是很微弱的,所以CO的体积分数不一定增大。错误。C.任何反应,无论是放热反应还是吸热反应,升高温度,化学反应速率都加快。即正反应速率增大,逆反应速率也加快。错误。D.恒容时,温度升高H2浓度减小。说明升高温度,化学平衡向正反应方向移动。根据平衡移动原理:升高温度,化学平衡向吸热反应方向移动。正反应是吸热反应,所以该反应的正反应的焓变为正值。正确。
CO(g)+H2O(g)。错误。B.在恒温恒容下,当反应达平衡时,若再通入一定量的CO2,由于增大了反应物的浓度,所以化学平衡正向移动,CO的物质的量增大,但由于平衡移动的趋势是很微弱的,所以CO的体积分数不一定增大。错误。C.任何反应,无论是放热反应还是吸热反应,升高温度,化学反应速率都加快。即正反应速率增大,逆反应速率也加快。错误。D.恒容时,温度升高H2浓度减小。说明升高温度,化学平衡向正反应方向移动。根据平衡移动原理:升高温度,化学平衡向吸热反应方向移动。正反应是吸热反应,所以该反应的正反应的焓变为正值。正确。
考点:考查化学平衡常数的应用、温度与化学反应速率、焓变的关系及浓度对物质含量的影响的知识。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列有关说法正确的是
| A.准确称取0.4000 g NaOH固体可配成100 mL 0.1000 mol·L-1的NaOH标准溶液 |
| B.催化剂可以加快化学反应速率但不能改变化学反应的焓变 |
| C.100 mL pH=3的HA和HB分别与足量的锌反应,HB放出的氢气多,说明HB酸性比HA弱 |
D.对于反应2SO2(g)+O2(g)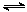 2SO3(g),压缩气体体积使压强增大(其他条件不变),则SO2的转化率增大,平衡常数K也增大 2SO3(g),压缩气体体积使压强增大(其他条件不变),则SO2的转化率增大,平衡常数K也增大 |
升高温度,下列数据不一定增大的是
A.化学反应速率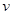 | B.KNO3的溶解度S |
| C.化学平衡常数K | D.水的离子积常数Kw |
下列过程属于熵(S)增加的是 ( )
| A.一定条件下,水由气态变成液态 | B.高温高压条件下使石墨转变成金刚石 |
| C.4NO2(g)+O2(g)=2N2O5 (g) | D.CaCO3(s)=CaO(s)+CO2(g) |
某同学用以下实验用品设计验证碘化钾与氯化铁反应的限度:0.1mol·L–1KI溶液、0.1mol·L–1FeCl3溶液、CCl4、淀粉溶液、KSCN溶液、试管、胶头滴管等。该同学设计的实验方案如图:
根据以上实验方案判断下列说法不正确的是
| A.试剂a是0.1mol·L–1KI溶液 |
| B.试剂d是KSCN溶液 |
| C.说明该反应已经发生的理由是③的下层呈紫色 |
| D.说明该反应是有限度的实验现象是④的上层溶液出现血红色 |
两体积的密闭容器中均充入1mol X和1mol Y,分别用于300℃和500℃开始发生反应:X(g)+Y(g) 3Z(g)。Z的含量(Z%)随时间t的变化如图所示。已知在
3Z(g)。Z的含量(Z%)随时间t的变化如图所示。已知在 时刻改变了某一实验条件。下列判断正确的是
时刻改变了某一实验条件。下列判断正确的是
| A.曲线a是500℃时的图像 | B.正反应是吸热反应 |
C. 时刻可能是增大了压强 时刻可能是增大了压强 | D. 时刻可能是降低了温度 时刻可能是降低了温度 |

 2C(g)在2L密闭容器中反应,0.5min内C的物质的量增加了0.6mol有关反应速率中正确的是 ( )
2C(g)在2L密闭容器中反应,0.5min内C的物质的量增加了0.6mol有关反应速率中正确的是 ( ) 3C(g)的下列叙述中,能说明反应已达到平衡的是
3C(g)的下列叙述中,能说明反应已达到平衡的是 2Z(g)一定达到化学平衡状态的是( )。
2Z(g)一定达到化学平衡状态的是( )。