题目内容
已知难溶电解质在水溶液中存在溶解平衡:
MmAn(s)
 mMn+(aq)+nAm-(aq)
mMn+(aq)+nAm-(aq)
Ksp=cm(Mn+) ·cn(Am-),称为溶度积。
某学习小组欲探究CaSO4沉淀转化为CaCO3沉淀的可能 性,查得如下资料:(25 ℃)
性,查得如下资料:(25 ℃)
MmAn(s)

 mMn+(aq)+nAm-(aq)
mMn+(aq)+nAm-(aq)Ksp=cm(Mn+) ·cn(Am-),称为溶度积。
某学习小组欲探究CaSO4沉淀转化为CaCO3沉淀的可能
 性,查得如下资料:(25 ℃)
性,查得如下资料:(25 ℃)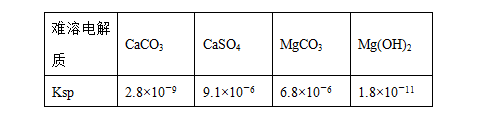
实验步骤如下:
①往100 mL 0.1 mol/L的CaCl2溶液中加入100 mL 0.1 mol/L的Na2SO4溶液,立即有白色沉淀生成。
②向上述悬浊 液中加入固体Na2CO3 3 g,搅拌,静置,沉淀后弃去上层清液。
液中加入固体Na2CO3 3 g,搅拌,静置,沉淀后弃去上层清液。
③再加入蒸馏水搅拌,静置,沉淀后再弃去上层清液。
④____________________________________________。
①往100 mL 0.1 mol/L的CaCl2溶液中加入100 mL 0.1 mol/L的Na2SO4溶液,立即有白色沉淀生成。
②向上述悬浊
 液中加入固体Na2CO3 3 g,搅拌,静置,沉淀后弃去上层清液。
液中加入固体Na2CO3 3 g,搅拌,静置,沉淀后弃去上层清液。③再加入蒸馏水搅拌,静置,沉淀后再弃去上层清液。
④____________________________________________。
(1)由题中信息Ksp越大,表示电解质的溶解度越______(填“大”或“小”)。
(2)写出第②步发生反应的化学方程式: ________________________________。
(3)设计第③步的目的是________________________。
(4)请补充第④步操作及发生的现象: __________________________。
(2)写出第②步发生反应的化学方程式: ________________________________。
(3)设计第③步的目的是________________________。
(4)请补充第④步操作及发生的现象: __________________________。
(1)大
(2)Na2CO3+CaSO4===Na2SO4+CaCO3
(3)洗去沉淀中附着的SO42-
(4)向沉淀中加入足量的盐酸,沉淀完全溶解
(2)Na2CO3+CaSO4===Na2SO4+CaCO3
(3)洗去沉淀中附着的SO42-
(4)向沉淀中加入足量的盐酸,沉淀完全溶解

练习册系列答案
相关题目
一定温度下的难溶电解质在水溶液中达到溶解平衡时。已知下表数据
|
物质 |
Fe(OH)2 |
Cu(OH)2 |
Fe(OH)3 |
|
Ksp/25℃ |
8.0×10-16 |
2.2×10-20 |
4.0×10-38 |
|
完全沉淀时的PH值 |
≥9.6 |
≥6.4 |
3~4 |
对含等物质的量的CuSO4、FeSO4、Fe2(SO4)3的混合溶液的说法,不科学的是
A.向该溶液中加少量铁粉不能观察到红色固体析出
B.该溶液中c(SO42-):[c(Cu2+)+c(Fe2+)+c(Fe3+)]>5:4
C.向该混合溶液中逐滴加入NaOH溶液,最先看到红褐色沉淀
D.向该溶液中加入适量氯水,并调节pH值到3~4后过滤,得到纯净的CuSO4溶液
 xC(g) △H = QKJ/mol
xC(g) △H = QKJ/mol