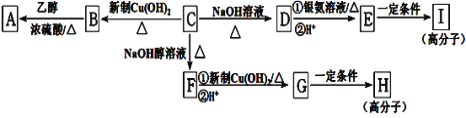
题目内容
【题目】元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为1。在气体分析中,常用XCl的盐酸溶液吸收并定量测定CO的含量,原理为:2XCl+2CO+ 2H2O==X2Cl2·2CO·2H2O
(1)X原子基态核外电子排布式为_________;
(2)C、H、O三种元素的电负性由大到小的顺序为________;
(3)H2O中氧原子的轨道杂化类型为__________;
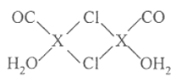
(4)X2Cl2·2CO·2H2O是一种配合物,结构如图所示,每个X原子能与其他原子形成3个配位键,在图中用“→"标出相应的配位键__。CO与N2分子的结构相似,则1molX2Cl2·2CO·2H2O含有δ键的数目为__。
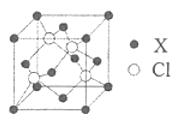
(5)化合物XCl晶体的晶胞如图所示,距离每个X离子最近的Cl的个数为________。
【答案】1s22s2p63s23p63d104s1或[Ar]3d104s1 O>C>H sp3 ![]() 14mol或14×6.02×1023 4
14mol或14×6.02×1023 4
【解析】
(1)元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为1,X为Cu,其原子基态核外电子排布式为1s22s2p63s23p63d104s1或[Ar]3d104s1;
(2)非金属性越强电负性越大,所以C、H、O三种元素的电负性由大到小的顺序为O>C>H;
(3)根据水的中心原子的氧原子的价电子数为(6+2)÷2=4,所以氧原子的杂化方式为sp3杂化;
(4)根据氯原子最外层电子数为7可知,氯原子可形成一对共用电子对,即氯原子形成两条共价键中只有一条是配位键,而X可形成3条配位键,故答案为![]() ,因1molX2Cl2·2CO·2H2O含有8mol配位键,4molH-O键,2molCO含2molδ键,H-O键和配位键都属于δ键,即1molX2Cl2·2CO·2H2O含有8+4+2=14molδ键,即14NA个δ键;
,因1molX2Cl2·2CO·2H2O含有8mol配位键,4molH-O键,2molCO含2molδ键,H-O键和配位键都属于δ键,即1molX2Cl2·2CO·2H2O含有8+4+2=14molδ键,即14NA个δ键;
(5)由晶包图可知晶包类型为ZnS,其晶包中配位数为4,距离每个X离子最近的Cl的个数为4。

 中考解读考点精练系列答案
中考解读考点精练系列答案