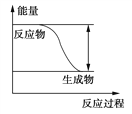
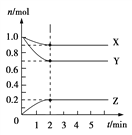
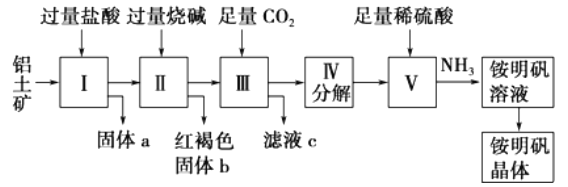
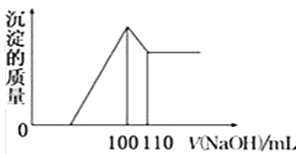
题目内容
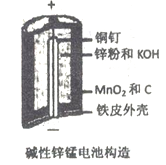
【题目】碱性锌锰电池是日常生活中消耗量最大的电池, 其构造如图所示。放电时总反应为:Zn + 2H2O + 2MnO2==Zn(OH)2 + 2MnOOH 从废旧碱性锌锰电池中回收Zn和MnO2的工艺如下:
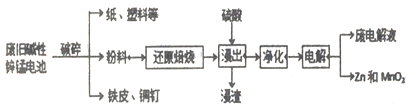
回答下列问题:
(1)“还原焙烧”过程中,高价金属化合物被还原为低价氧化物或金属单质(其中MnOOH、MnO2被还原成MnO),碳作为还原剂生成CO2,则CO2的电子式为___________。
(2)“净化”是为了除去浸出液中的Fe2+,方法是:加入______(填化学式)溶液将Fe2+氧化为Fe3+,再调节pH使Fe3+完全沉淀。己知浸出液中Mn2+、Zn2+的浓度约为0.1mol·L-1,根据下列数据计算,调节pH的合理范围是____至_______。
化合物 | Mn(OH)2 | Zn(OH)2 | Fe(OH)3 |
Ksp近似值 | 10-13 | 10-17 | 10-38 |
(离子浓度小于1×10-5 mol·L-1即为沉淀完全)
(3)“电解”时,阳极的电极反应式为______________。
本工艺中应循环利用的物质是____________(填化学式)。
(4)若将“粉料”直接与盐酸共热反应后过滤,滤液的主要成分是ZnCl2和MnCl2。“粉料”中的MnOOH与盐酸反应的化学方程式为___________________。
(5)某碱性锌锰电池维持电流强度0.5A (相当于毎秒通过5×10-6mol电子),连续工作80分钟即接近失效。如果制造一节电池所需的锌粉为6 g,则电池失效时仍有________%的金属锌未参加反应。
【答案】 ![]() H2O2 (或KMnO4) 3 6 Mn2+-2e-+2H2O=MnO2+4H+ H2SO4 2MnOOH+6HCl
H2O2 (或KMnO4) 3 6 Mn2+-2e-+2H2O=MnO2+4H+ H2SO4 2MnOOH+6HCl![]() Cl2↑+2MnCl2↑+4H2O 87
Cl2↑+2MnCl2↑+4H2O 87
【解析】(1)CO2是共价化合物,其CO2的电子式为![]() ;
;
(2) “净化”是为了除去浸出液中的Fe2+,利用H2O2溶液具有氧化性将Fe2+氧化为Fe3+,再由Mn(OH)2、Zn(OH)2的KSP近似值可求得Mn2+,Zn2+开始沉淀时的氢氧根浓度分别为![]() =10-6,
=10-6, ![]() =10-8,即Mn2+,Zn2+开始沉淀时的pH分别为8和6,而Fe(OH)3沉淀完全时的氢氧根浓度为
=10-8,即Mn2+,Zn2+开始沉淀时的pH分别为8和6,而Fe(OH)3沉淀完全时的氢氧根浓度为![]() =10-11,即Fe(OH)3沉淀完全时的pH为3,所以调节pH的合理范围是 3-6,使Fe3+完全沉淀,Mn2+,Zn2+不沉淀;
=10-11,即Fe(OH)3沉淀完全时的pH为3,所以调节pH的合理范围是 3-6,使Fe3+完全沉淀,Mn2+,Zn2+不沉淀;
(3)电解阳极Mn2+失电子发生氧化反应生成MnO2,阳极的电极反应式为Mn2+-2e-+2H2O=MnO2+4H+,阴极Zn2+得电子发生还原反应生成Zn,废电解液为硫酸,则本工艺中应循环利用的物质是H2SO4 ;
(4)“粉料”中的MnOOH具有氧化性,与盐酸发生氧化还原反应,则反应的化学方程式为2MnOOH+6HCl![]() 2MnCl2+4H2O+Cl2↑;
2MnCl2+4H2O+Cl2↑;
(5)80分钟转移电子的物质的量为5×10-6 mol×80×60=0.024mol,则消耗的Zn的质量为![]() ×65g/mol=0.78g,所以如果制造一节电池所需的锌粉为6g,则电池失效时仍有
×65g/mol=0.78g,所以如果制造一节电池所需的锌粉为6g,则电池失效时仍有![]() ×100%=87%的金属锌未参加反应。
×100%=87%的金属锌未参加反应。

【题目】【河北省邢台市第二中学2017届高三上学期第三次月考】下述实验不能达到预期目的的是
编号 | 实验内容 | 实验目的 |
A | 将 | 制备 |
B | 向沸水中滴加几滴 | 制备 |
C | 向某溶液中加入稀 | 检验溶液中是否含有 |
D | 相同温度下,测定浓度分别为0.1mol·L-1的 | 比较 |