题目内容
8.4.8g O2和0.2mol CO2物质量比是3:4,质量比是6:11,原子数比是1:2.分析 根据n=$\frac{m}{M}$=$\frac{N}{{N}_{A}}$结合物质的构成计算.
解答 解:n(O2)=$\frac{4.8g}{32g/mol}$=0.15mol,n(CO2)=0.2mol,m(CO2)=0.2mol×44g/mol=8.8g,
则4.8g O2和0.2mol CO2物质的量比是0.15mol:0.2mol=3:4,质量比是 4.8g:8.8g=6:11,原子数比是0.15mol×2:0.2mol×3=1:2,
故答案为:3:4;6:11;1:2.
点评 本题考查常用化学计量的有关计算,为高频考点,侧重于学生的分析能力的考查,难度不大,注意把握物质的构成特点以及相关计算公式的运用.

练习册系列答案
相关题目
18.在化学学习中使用数轴的表示方法可起到直观、形象的效果,下列表达中不正确的是( )
| A. | 常温下溶液的pH与酸碱性的关系: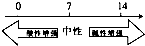 | |
| B. | 硫的化合物中化合价与其氧化性、还原性的关系: | |
| C. | Fe在Cl2中的燃烧产物: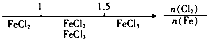 | |
| D. | 氨水与SO2反应后溶液中的铵盐: |
16.用NA表示阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 0.5mol O2所含氧元素数为NA | |
| B. | 0.2mol H2O所含的氢原子数为0.2NA | |
| C. | 0.1mol CH4所含电子数为NA | |
| D. | 2mol MgCl2中所含离子数为4NA |
3.2mol Cl2和2mol CO2相比较,下列叙述中正确的是( )
| A. | 分子数相等 | B. | 原子数相等 | C. | 质子数相等 | D. | 质量相等 |

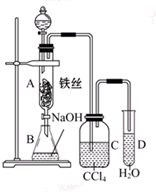 某化学课外小组查阅资料知:苯和液溴在有铁存在的条件下可发生反应生 成溴苯和溴化氢,此反应为 放热反应.他们用如图所示 装置制取溴苯.已知:溴蒸气为红棕色
某化学课外小组查阅资料知:苯和液溴在有铁存在的条件下可发生反应生 成溴苯和溴化氢,此反应为 放热反应.他们用如图所示 装置制取溴苯.已知:溴蒸气为红棕色 ,观察到A中的现象反应混合液微沸,有红棕色气体充满A容器.实验结束时,打开A下端的活塞,让反应液流入B中,充分振荡,目的是除去溶于溴苯中的溴,写出有关反应的化学方程式Br2+2NaOH═NaBr+NaBrO+H2O.
,观察到A中的现象反应混合液微沸,有红棕色气体充满A容器.实验结束时,打开A下端的活塞,让反应液流入B中,充分振荡,目的是除去溶于溴苯中的溴,写出有关反应的化学方程式Br2+2NaOH═NaBr+NaBrO+H2O.