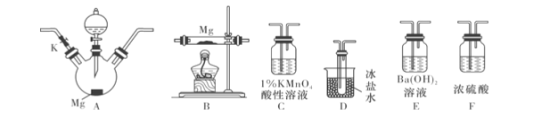
��Ŀ����
����Ŀ��ij�ᾧˮ���ﺬ�����������Ӻ�һ�������ӣ���ȡ����������Ϊ1.96g�ĸýᾧˮ����ֱ��Ƴ���Һ�� һ�ݼ�������Ba��OH��2��Һ�����ɰ�ɫ�������漴������Ϊ����ɫ�������к��ɫ�����ȸû����ݳ�0.224L����״������ʹʪ��ĺ�ɫʯ����ֽ���������壻��ϡ���ᴦ���������ϴ�Ӻ���õ���ɫ����2.33g��
��һ�ݼ��뺬0.001molKMnO4��������Һ��MnO4��ǡ����ȫ����ԭΪMn2+ ��
��ش��������⣺
��1���ýᾧˮ�����к��е��������������� �� �������� ��
��2���ýᾧˮ����Ļ�ѧʽ ��
���𰸡�
��1��NH4+��Fe2+��SO42��
��2����NH4��2Fe��SO4��2?6H2O��[��NH4��2SO4?FeSO4?6H2O]
���������⣺��1��һ�ݼ�������Ba��OH��2��Һ�����ɰ�ɫ�������漴������Ϊ����ɫ�������к��ɫ��˵������Fe2+���ӣ����ȸû����ݳ�0.224L����״������ʹʪ��ĺ�ɫʯ����ֽ���������壬˵������NH4+ �� ��ϡ���ᴦ���������ϴ�Ӻ���õ���ɫ����2.33g��˵������SO42�� �� ���Դ��ǣ�NH4+��Fe2+��SO42������2����������Ϣ��֪1.96g�ĸýᾧˮ�����У�n��NH4+��= ![]() =0.01mol������Ϊ��m��NH4+��=0.01mol��18g/mol=0.18g��n��SO42����=
=0.01mol������Ϊ��m��NH4+��=0.01mol��18g/mol=0.18g��n��SO42����= ![]() =0.01mol������Ϊ��m��SO42����=0.01mol��96g/mol=0.96g��KMnO4��������Һ���������ԣ���Fe2+����������ԭ��Ӧ�����ݵ�ʧ���ӵ����ʵ�����ȣ� ���У�0.001mol����7��2��=n����3��2��n=0.005mol����Fe2+�����ʵ���Ϊ0.005mol������Ϊ��0.005mol��56g/mol=0.28g�����Խᾧˮ������ˮ������Ϊ��1.96g��0.18g��0.96g��0.28g=0.54g��n��H2O��=
=0.01mol������Ϊ��m��SO42����=0.01mol��96g/mol=0.96g��KMnO4��������Һ���������ԣ���Fe2+����������ԭ��Ӧ�����ݵ�ʧ���ӵ����ʵ�����ȣ� ���У�0.001mol����7��2��=n����3��2��n=0.005mol����Fe2+�����ʵ���Ϊ0.005mol������Ϊ��0.005mol��56g/mol=0.28g�����Խᾧˮ������ˮ������Ϊ��1.96g��0.18g��0.96g��0.28g=0.54g��n��H2O��= ![]() =0.03mol�����ԣ�1.96g�ĸýᾧˮ�����У�m��NH4+����n��Fe2+����n��SO42������n��H2O��=0.01mol��0.005mol��0.01mol��0.03mol=2��1��2��6���ýᾧˮ����Ļ�ѧʽΪ����NH4��2Fe��SO4��26H2O��[��NH4��2SO4FeSO46H2O]�����Դ��ǣ���NH4��2Fe��SO4��26H2O��[��NH4��2SO4FeSO46H2O]��
=0.03mol�����ԣ�1.96g�ĸýᾧˮ�����У�m��NH4+����n��Fe2+����n��SO42������n��H2O��=0.01mol��0.005mol��0.01mol��0.03mol=2��1��2��6���ýᾧˮ����Ļ�ѧʽΪ����NH4��2Fe��SO4��26H2O��[��NH4��2SO4FeSO46H2O]�����Դ��ǣ���NH4��2Fe��SO4��26H2O��[��NH4��2SO4FeSO46H2O]��