题目内容
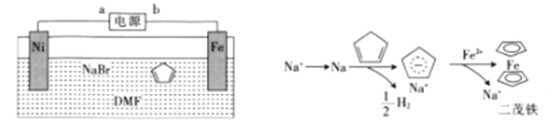
【题目】如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置。请回答下列问题:
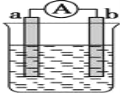
(1)当电极a为Al,电极b为Cu,电解质溶液为稀硫酸时,正极的电极反应式为:__________
(2)当电极a为Al,电极b为Mg,电解质溶液为氢氧化钠溶液时,该装置__________(填“能”或“不能”)形成原电池,若不能,请说明理由;若能,请指出正、负极材料:__________。当反应中收集到标准状况下224mL气体时,消耗的电极质量为__________g。
(3)燃料电池工作原理是将燃料和氧化剂(如O2)反应产生的化学能直接转化为电能。现设计一燃料电池,以电极a为正极,电极b为负极,甲烷为燃料,采用氢氧化钠溶液为电解液;则甲烷应通入________极(填a或b,下同),
【答案】2H++2e-=H2↑ 能 Al为负极,Mg为正极 0.18 b
【解析】
(1)Al、Cu、稀硫酸构成的原电池,金属铝做负极,金属铜为正极,正极上氢离子得电子生成氢气,正极的电极反应为:2H++2e-=H2↑,故答案为:2H++2e-=H2↑;
(2)当电极a为Al、电极b为Mg、电解质溶液为氢氧化钠溶液时,由于能和氢氧化钠溶液反应的是金属铝,所以此时铝是负极失去电子,镁是正极,溶液中的氢离子放电产生氢气,所以在两电极上所发生的现象为负极铝片溶解,正极镁片上有气泡产生发生反应2H2O+2e-=H2↑+2OH-,标准状况下224mL气体为0.01mol氢气则转移0.02mol电子,故消耗Al的质量为![]() ,故答案为:能;Al为负极,Mg为正极;0.18;
,故答案为:能;Al为负极,Mg为正极;0.18;
(3)氢氧燃料电池中,燃料甲烷需通在负极,正极是氧气得电子,电子从负极流向正极,负极上甲烷失电子生成二氧化碳,则负极电极方程式为:CH4+2H2O-8e-=CO2+8H+;
故答案为:b。

 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案