题目内容
【题目】为了实现“将全球温度上升幅度控制在2℃以内”的目标,科学家正在研究温室气体CO2的转化和利用。
(1)海洋是地球上碳元素的最大“吸收池”
①溶于海水中的CO2主要以四种无机碳形式存在,分别为CO2、H2CO3、CO32-和_________(填离子符号)。
②在海洋中,可通过如图所示的途径来固碳。则发生光合作用时,CO2与H2O反应生成(CH2O)x和O2的化学方程式为__________________。

(2)有科学家提出可利用FeO来吸收CO2,已知:
C(s)+2H2O(g)![]() CO2(g)+2H2(g) △H=+113.4 kJ·mol-1
CO2(g)+2H2(g) △H=+113.4 kJ·mol-1
3FeO(s)+H2O(g)![]() Fe3O4(s)+H2(g) △H=+18.7 kJ·mol-1
Fe3O4(s)+H2(g) △H=+18.7 kJ·mol-1
则6FeO(s)+CO2(g)![]() 2Fe3O4(s)+C(s) △H=_____kJ·mol-1。
2Fe3O4(s)+C(s) △H=_____kJ·mol-1。
(3)以CO2为原料可制备甲醇:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),向一恒容密闭容器中充入1moCO2(g)和3molH2(g),测得CO2(g)和CH3OH(g)的浓度随时间的变化如图所示。
CH3OH(g)+H2O(g),向一恒容密闭容器中充入1moCO2(g)和3molH2(g),测得CO2(g)和CH3OH(g)的浓度随时间的变化如图所示。
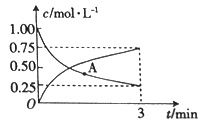
①若A点的正反应速率用v正(CO2)来表示,A点的逆反应速率用v逆(CO2)来表示,则v正(CO2)_______(填“>”“ <”或“=”)v逆(CO2)。
②0~3min内,氢气的平均反应速率v(H2)_______________。
(4)在一定条件下,二氧化碳转化为甲烷:CO2(g)+4H2(g)![]() CH4(g)+2 H2O(g),△H。向一密闭容积正充入一定量的CO2和H2,在300℃时发生上述反应,达到平衡时测得c(CO2)= 0.2 mol·L-1,c(H2) =0.8 mol·L-1,c(H2O)=1.6mol·L-1。则该温度下上述反应的平衡常数K= ________。若200℃时该反应的平衡常数K=64.8,则该反应的△H_____(填“>’’或“<”)O。
CH4(g)+2 H2O(g),△H。向一密闭容积正充入一定量的CO2和H2,在300℃时发生上述反应,达到平衡时测得c(CO2)= 0.2 mol·L-1,c(H2) =0.8 mol·L-1,c(H2O)=1.6mol·L-1。则该温度下上述反应的平衡常数K= ________。若200℃时该反应的平衡常数K=64.8,则该反应的△H_____(填“>’’或“<”)O。
【答案】 HCO3- ![]() -76.0 > 0.75mol·L-1·min-1 25 <
-76.0 > 0.75mol·L-1·min-1 25 <
【解析】(1)①溶于海水中的CO2主要以四种无机碳形式存在,分别为CO2、H2CO3、CO32-和HCO3-;②发生光合作用时,CO2与H2O在叶绿素和酶的作用下反应生成(CH2O)x和O2,其反应的化学方程式为:![]() ;(2)已知:①C(s)+2H2O(g)
;(2)已知:①C(s)+2H2O(g)![]() CO2(g)+2H2(g) △H1=+113.4 kJ·mol-1 ,
CO2(g)+2H2(g) △H1=+113.4 kJ·mol-1 ,
②3FeO(s)+H2O(g)![]() Fe3O4(s)+H2(g) △H2=+18.7 kJ·mol-1,根据盖斯定律,由②×2-①可得反应:6FeO(s)+CO2(g)
Fe3O4(s)+H2(g) △H2=+18.7 kJ·mol-1,根据盖斯定律,由②×2-①可得反应:6FeO(s)+CO2(g)![]() 2Fe3O4(s)+C(s) △H=2△H2-△H1=+18.7 kJ·mol-1×2-113.4 kJ·mol-1 = -76.0kJ·mol-1;(3) ①根据图中信息可知,CO2(g)的浓度还在降低,CH3OH(g)的浓度还在增大,反应还在向正方向进行且没达到平衡状态,则v正(CO2) >v逆(CO2);②0~3min内,CO2的平均反应速率v(CO2)=
2Fe3O4(s)+C(s) △H=2△H2-△H1=+18.7 kJ·mol-1×2-113.4 kJ·mol-1 = -76.0kJ·mol-1;(3) ①根据图中信息可知,CO2(g)的浓度还在降低,CH3OH(g)的浓度还在增大,反应还在向正方向进行且没达到平衡状态,则v正(CO2) >v逆(CO2);②0~3min内,CO2的平均反应速率v(CO2)=![]() ,化学反应速率之比等于计量数之比,则氢气的平均反应速率v(H2)=3 v(CO2)=
,化学反应速率之比等于计量数之比,则氢气的平均反应速率v(H2)=3 v(CO2)=![]() ×3=0.75mol·L-1·min-1;(4)c(CH4)=
×3=0.75mol·L-1·min-1;(4)c(CH4)=![]() c(H2O)=
c(H2O)=![]() ×1.6mol·L-1=0.8 mol·L-1,根据反应CO2(g)+4H2(g)
×1.6mol·L-1=0.8 mol·L-1,根据反应CO2(g)+4H2(g)![]() CH4(g)+2 H2O(g)可得300℃时,平衡常数K=
CH4(g)+2 H2O(g)可得300℃时,平衡常数K=![]() =
=![]() =25;若200℃时该反应的平衡常数K=64.8>25,则升高温度,平衡常数减小,则平衡向逆反应方向移动,逆反应方向为吸热反应,正反应方向为放热反应,△H<0。
=25;若200℃时该反应的平衡常数K=64.8>25,则升高温度,平衡常数减小,则平衡向逆反应方向移动,逆反应方向为吸热反应,正反应方向为放热反应,△H<0。





