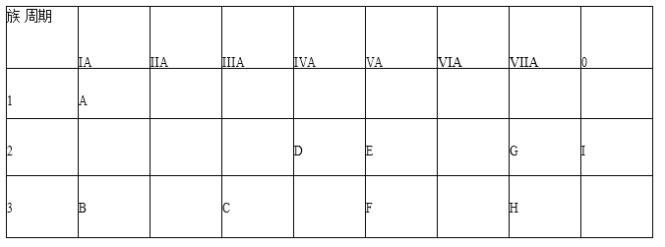
题目内容
【题目】今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、、NH4+、Cl—、Mg2+、Ba2+、CO32—、SO42—,现取三份 100mL 溶液进行如下实验:(1)第一份加入 AgNO3 溶液有沉淀产生;(2)第二份加足量 NaOH 溶液加热后,收集到气体 0.04mol;(3)第三份加足量 BaCl2 溶液后,得干燥沉淀 6.27g,经足量盐酸洗涤、干燥后,沉淀质量为 2.33g。根据上述实验,以下推测正确的是( )
A.Cl—可能存在B.Ba2+一定不存在,Mg2+可能存在
C.c(K+)=0.1mol/LD.100mL 溶液中含有 0.01mol CO32—
【答案】A
【解析】
第一份加入AgNO3溶液后有沉淀生成,溶液中可能含有Cl-,SO42-,CO32-;第二份加足量NaOH有气体,一定含有NH4+,没有沉淀生成,一定没有Mg2+;第三份有沉淀后加酸沉淀部分溶解一定存在CO32-、SO42-,不存在Ba2+;所以一定存在的离子是NH4+ 、CO32-、SO42-;根据题给信息,生成0.04 mol NH3,溶液中NH4+的物质的n(NH4+)=0.04mol;生成硫酸钡沉淀2.33g,溶液中n(SO42-)=n(BaSO4)=![]() =0.01mol,则碳酸钡沉淀质量为6.27g-2.33g=3.94g,则溶液中n(CO32-)= n(BaCO3)=
=0.01mol,则碳酸钡沉淀质量为6.27g-2.33g=3.94g,则溶液中n(CO32-)= n(BaCO3)=![]() =0.02mol,最后根据溶液中存在电荷守恒关系确定钾离子是否存在,据以上分析解答。
=0.02mol,最后根据溶液中存在电荷守恒关系确定钾离子是否存在,据以上分析解答。
根据上述分析可知,n(NH4+)=0.04mol;n(SO42-)=![]() =0.01mol,n(CO32-)=
=0.01mol,n(CO32-)=![]() =0.02mol,因为电解质溶液呈电中性,所以0.04molNH4+带的正电荷总量为0.04mol,而0.02molCO32-带的负电荷总量为0.04 mol,0.01molSO42-带的负电荷总量为0.02mol,因此该溶液中一定含有阳离子钾离子0.02 mol;当溶液中如果再含有Cl-,那么n(K+)>0.02mol。
=0.02mol,因为电解质溶液呈电中性,所以0.04molNH4+带的正电荷总量为0.04mol,而0.02molCO32-带的负电荷总量为0.04 mol,0.01molSO42-带的负电荷总量为0.02mol,因此该溶液中一定含有阳离子钾离子0.02 mol;当溶液中如果再含有Cl-,那么n(K+)>0.02mol。
结合以上分析可知,该混合物中一定含有K+、NH4+、CO32-、SO42-,可能含有Cl-,且n(K+)≥0.02mol,
则
A. Cl—可能存在,A项正确;
B. 二份加足量 NaOH 有气体,一定含有NH4+,没有沉淀一定没有Mg2+; 第三份有沉淀后加酸沉淀部分溶解一定存在CO32-、SO42-,不存在Ba2+,故Ba2+和Mg2+一定不存在,B项错误;
C. n(K+) ≥ 0.02mol,则c(K+)≥![]() =0.2mol/L,C项错误;
=0.2mol/L,C项错误;
D. 100mL 溶液中含有 0.02mol CO32—,D项错误;
答案选A。

【题目】某学生用NaOH标准溶液滴定未知浓度的盐酸,进行了如下实验:取15 mL待测溶液于250 mL锥形瓶中,加入1~2滴酚酞试液,用NaOH标准溶液滴定。按上述操作方法再重复2次。
(1)填空:(①、②小题中选填“偏高”、“偏低”或“无影响”)
①装碱滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则待测液的浓度________;
②锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去NaOH标准溶液的体积________;
③滴定时边滴边摇动锥形瓶,眼睛应观察________________________;
④滴定达到终点时,酚酞指示剂由________色变成________色。
(2)滴定结果如下表所示:
滴定次数 | 标准溶液的体积/mL | 待测盐酸溶液的体积/ mL | |
滴定前刻度 | 滴定后刻度 | ||
1 | 1.05 | 21.10 | 15.00 |
2 | 2.00 | 21.95 | 15.00 |
若NaOH标准溶液的浓度为0.1010 mol/L,则待测液的浓度为________。