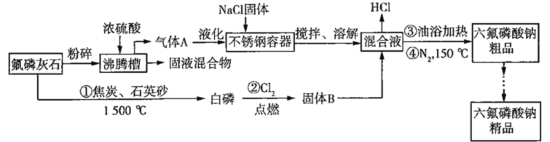
题目内容
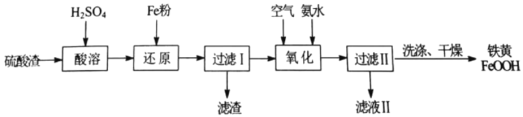
【题目】以硫酸渣(主要含Fe2O3、FeO,杂质为Al2O3和SiO2等)为原料制备铁黄(FeOOH)的一种工艺流程如下:
(1)“酸溶”时加快溶解的方法可以是________。(写出一种)
(2)“还原”过程中主要反应的离子方程式为________。
(3)“氧化”过程中,生成FeOOH的离子方程式为________。
(4)“过滤Ⅱ”所得铁黄在洗涤过程中,检验铁黄表面已洗涤干净的操作是________。
(5)实验测得反应溶液的![]() 、温度对铁黄产率的影响如图1、图2所示。
、温度对铁黄产率的影响如图1、图2所示。
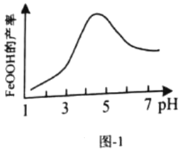
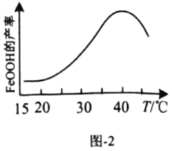
①反应温度宜选择________;
②氧化时应控制pH的合理范围是4.5左右,pH过小或过大均会导致铁黄产率较低,其可能原因是________。
【答案】快速搅拌或适当提高酸溶时温度 Fe+2Fe3+=3Fe2+ ![]() 取最后一次洗涤滤液,滴加盐酸酸化的BaCl2溶液,若无白色沉淀,说明已洗涤干净 40℃ pH过低导致Fe3+不可能完全转为铁黄,pH过大导致部分Fe3+会转化为Fe(OH)3
取最后一次洗涤滤液,滴加盐酸酸化的BaCl2溶液,若无白色沉淀,说明已洗涤干净 40℃ pH过低导致Fe3+不可能完全转为铁黄,pH过大导致部分Fe3+会转化为Fe(OH)3
【解析】
硫酸渣(主要含Fe2O3、FeO,杂质为Al2O3和SiO2等)加硫酸溶解,金属氧化物转化为金属阳离子,二氧化硅不溶,再加铁粉把铁离子还原为Fe2+,之后进行过滤,滤渣主要为不溶于稀硫酸的二氧化硅,滤液中含有Fe2+和Al3+,滤液中通入空气氧化,同时加入氨水调节pH生成FeOOH沉淀,过滤、洗涤、烘干,得到纯净的FeOOH;
(1)快速搅拌、适当提高酸溶时温度均可以加快溶解的速率;
(2)还原过程主要为铁粉和铁离子的反应,离子方程式为Fe+2Fe3+=3Fe2+;
(3)根据流程可知氧化过程中氧化剂为O2,Fe2+在碱性环境中被氧化成FeOOH,铁元素化合价升高1价,所以反应中Fe2+和O2的系数比为4:1,再结合元素守恒可得离子方程式为![]() ;
;
(4)根据整个流程可知生成的铁黄表面可能附着硫酸铵,所以需要检验铁黄表面是否存在硫酸根来验证铁黄是否洗涤干净,具体操作为:取最后一次洗涤滤液,滴加盐酸酸化的BaCl2溶液,若无白色沉淀,说明已洗涤干净;
(5)①据图可知温度为40℃时铁黄的产率最高,所以温度选40℃;
②pH过低导致Fe3+不可能完全转为铁黄,pH过大导致部分Fe3+会转化为Fe(OH)3,所以pH过小或过大均会导致铁黄产率较低。

 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案【题目】硫化氢(H2S)是一种无色具有臭鸡蛋气味、能溶于水的高毒性的化合物,其广泛存在化石燃料加工的尾气中。为避免污染环境,可用活性炭材料进行脱硫,脱硫的方法有物理吸附法、化学吸附法和氧化法。
(1)物理吸附法:
物理吸附法是先将尾气缓缓通过活性炭,将H2S从尾气中转移到活性炭的微孔或表面,这是利用活性炭的___性。
(2)氧化法:
利用吸附在活性炭表面上的活性氧(O),将H2S氧化成S而除去,该反应的化学方程式是___。
(3)化学吸附法:
①利用H2S能溶于水,形成硫化氢溶液,更易被活性炭吸附。若0.1molL-1H2S的pH约为4,则H2S在水溶液中的电离方程式是___,被吸附的离子主要有___。
②工业生产中用CuCl2溶液处理活性炭的工艺称为活性炭的改性,改性后的活性炭能提高化学吸附法中H2S的吸收量。
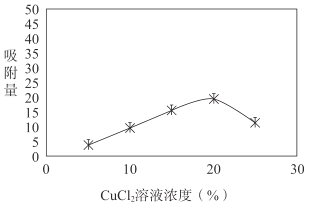
i.用不同浓度的CuCl2溶液改性后的活性炭对H2S吸附量的影响如图所示。随着CuCl2溶液浓度的升高,活性炭对硫化氢吸附量不再增加,原因是过多金属离子阻塞活性炭内部的微孔结构,导致活性炭的吸附能力下降。改性后的活性炭,能提高H2S吸附量的原因是___(用离子方程式表示)。
ii.水膜处理对活性炭吸附H2S量也有影响。测定含水量不同时,活性炭对硫化氢吸附量的影响,实验结果如下表。
载水率(%) | 0 | 5.32 | 10.23 | 15.33 | 20.19 |
吸附量(mg/g—活性炭) | 19.62 | 21.52 | 32.42 | 31.28 | 30.78 |
注:载水率即单位质量的活性炭吸附水的质量。
活性炭载水率为10%以上时,吸附量降低,其可能的原因是___。
(4)下列关于活性炭处理H2S尾气的说法正确的是___(选填字母序号)。
a.化学吸附过程中存在着电离平衡的移动
b.活性炭改性时,CuCl2溶液的浓度越大,H2S的吸附量越大
c.其他条件相同时,低温、缓慢通入尾气更有利于H2S的物理吸附
d.适当提高活性炭的载水率,可提高H2S吸附量的原因是活性炭吸附离子比吸附分子能力更强