题目内容
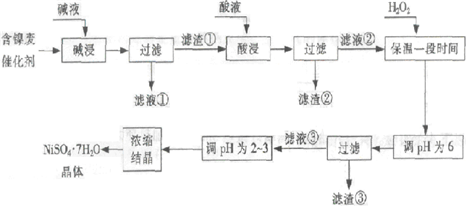
从含镍废催化剂中可回收镍,其流程如下:

某油脂化工厂的含镍催化剂主要含有Ni,还含有Al(31%)、Fe(1.3%)的单质及氧化物,其他不溶杂质(3.3%).部分阳离子以氢氧化物形式完全沉淀时的pH如下:
回答下列问题:
(1)“碱浸”的目的是除去
(2)“酸浸”时所加入的酸是
(3)“调pH为2~3”的目的是
(4)产品晶体中有时会混有少量绿矾(FeSO4?7H2O),可能是由于生产过程中
(5)NiSO4在强碱溶液中用NaClO氧化,可制得碱性镍镉电池电极材料--NiOOH.该反应的离子方程式是

某油脂化工厂的含镍催化剂主要含有Ni,还含有Al(31%)、Fe(1.3%)的单质及氧化物,其他不溶杂质(3.3%).部分阳离子以氢氧化物形式完全沉淀时的pH如下:
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
| pH | 5.2 | 3.2 | 9.7 | 9.2 |
(1)“碱浸”的目的是除去
Al、Al2O3、油脂
Al、Al2O3、油脂
.(2)“酸浸”时所加入的酸是
H2SO4
H2SO4
(填化学式).酸浸后,滤液②中可能含有的金属离子是Ni2+、Fe2+
Ni2+、Fe2+
.(3)“调pH为2~3”的目的是
防止在浓缩结晶过程中Ni2+水解
防止在浓缩结晶过程中Ni2+水解
.(4)产品晶体中有时会混有少量绿矾(FeSO4?7H2O),可能是由于生产过程中
H2O2的用量不足(或H2O2失效)、保温时间不足导致Fe2+未被完全氧化造成的
H2O2的用量不足(或H2O2失效)、保温时间不足导致Fe2+未被完全氧化造成的
.(5)NiSO4在强碱溶液中用NaClO氧化,可制得碱性镍镉电池电极材料--NiOOH.该反应的离子方程式是
2Ni2++ClO-+4OH-=2NiOOH↓+Cl-+H2O
2Ni2++ClO-+4OH-=2NiOOH↓+Cl-+H2O
.分析:(1)含镍催化剂主要含有Ni,还含有Al(31%)的单质及氧化物,铝和氧化铝都可以和强酸强碱反应溶解得到溶液含有偏铝酸盐;
(2)依据最后制备NiSO4?7H2O,防止引入其它杂质离子需要加入硫酸进行溶解;铁及其化合物、镍和硫酸反应生成亚铁离子和镍离子,过滤后得到溶液为硫酸亚铁和硫酸镍溶液;
(3)调节溶液PH为酸性防止镍离子水解,减少镍离子的损失;
(4)含有绿矾晶体说明在加入过氧化氢保温过程中,过氧化氢未把亚铁离子全部氧化;
(5)依据NiSO4在强碱溶溶中用NaClO氧化,可制得碱性镍镉电池电极材料--NiOOH,次氯酸钠被还原为氯离子,结合电荷守恒、原子守恒书写离子方程式.
(2)依据最后制备NiSO4?7H2O,防止引入其它杂质离子需要加入硫酸进行溶解;铁及其化合物、镍和硫酸反应生成亚铁离子和镍离子,过滤后得到溶液为硫酸亚铁和硫酸镍溶液;
(3)调节溶液PH为酸性防止镍离子水解,减少镍离子的损失;
(4)含有绿矾晶体说明在加入过氧化氢保温过程中,过氧化氢未把亚铁离子全部氧化;
(5)依据NiSO4在强碱溶溶中用NaClO氧化,可制得碱性镍镉电池电极材料--NiOOH,次氯酸钠被还原为氯离子,结合电荷守恒、原子守恒书写离子方程式.
解答:解:(1)“碱浸”过程中是为了除去铝及其氧化物极其油脂,铝是两性元素和强碱反应,氧化铝是两性氧化物和强碱反应,镍单质和铁及其氧化物不和碱反应达到除去铝元素的目的;反应的两种方程式为:2Al+2OH-+2H2O═2AlO2-+3H2↑、Al2O3+2OH-═2AlO2-+3H2O,
故答案为:Al、Al2O3、油脂;
(2)“酸浸”时主要是溶解镍金属和铁单质及其氧化物,依据制备目的是得到NiSO4?7H2O,加入的酸不能引入新的杂质,所以需要加入硫酸进行酸浸;镍、铁和稀硫酸反应生成硫酸亚铁、硫酸镍溶液,
故答案为:H2SO4;Ni2+、Fe2+;
(3)硫酸镍溶液需要蒸发浓缩结晶析出,为防止镍离子水解生成氢氧化镍沉淀,需要控制溶液pH在酸性条件下,
故答案为:防止在浓缩结晶过程中Ni2+水解(或“防止在浓缩结晶过程生成Ni(OH)2沉淀);
(4)产品晶体中有时会混有少量绿矾(FeSO4?7H2O),说明在加入过氧化氢氧化剂氧化亚铁离子时未把亚铁离子全部氧化,氢氧化亚铁沉淀的pH大于镍离子沉淀的pH,保温目的是把亚铁离子完全氧化,
故答案为:H2O2的用量不足(或H2O2失效)、保温时间不足导致Fe2+未被完全氧化造成的;
(5)NiSO4在强碱溶溶中用NaClO氧化,可制得碱性镍镉电池电极材料--NiOOH.该反应的离子方程式是:2Ni2++ClO-+4OH-=2NiOOH+Cl-+H2O,
故答案为:2Ni2++ClO-+4OH-=2NiOOH↓+Cl-+H2O.
故答案为:Al、Al2O3、油脂;
(2)“酸浸”时主要是溶解镍金属和铁单质及其氧化物,依据制备目的是得到NiSO4?7H2O,加入的酸不能引入新的杂质,所以需要加入硫酸进行酸浸;镍、铁和稀硫酸反应生成硫酸亚铁、硫酸镍溶液,
故答案为:H2SO4;Ni2+、Fe2+;
(3)硫酸镍溶液需要蒸发浓缩结晶析出,为防止镍离子水解生成氢氧化镍沉淀,需要控制溶液pH在酸性条件下,
故答案为:防止在浓缩结晶过程中Ni2+水解(或“防止在浓缩结晶过程生成Ni(OH)2沉淀);
(4)产品晶体中有时会混有少量绿矾(FeSO4?7H2O),说明在加入过氧化氢氧化剂氧化亚铁离子时未把亚铁离子全部氧化,氢氧化亚铁沉淀的pH大于镍离子沉淀的pH,保温目的是把亚铁离子完全氧化,
故答案为:H2O2的用量不足(或H2O2失效)、保温时间不足导致Fe2+未被完全氧化造成的;
(5)NiSO4在强碱溶溶中用NaClO氧化,可制得碱性镍镉电池电极材料--NiOOH.该反应的离子方程式是:2Ni2++ClO-+4OH-=2NiOOH+Cl-+H2O,
故答案为:2Ni2++ClO-+4OH-=2NiOOH↓+Cl-+H2O.
点评:本题考查了金属回收的基本方法、难溶电解质的溶解与沉淀应用、沉淀转化的条件,掌握铝、铁、镍元素化合物的化学性质,利用溶液不同PH条件下离子沉淀的情况不同,控制溶液pH的方法除去杂质离子是解答的关键,题目难度中等.

练习册系列答案
相关题目
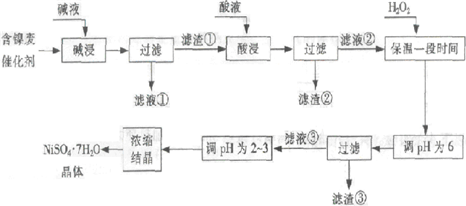
从含镍废催化剂中可回收镍,其流程如下:
某油脂化工厂的含镍催化剂主要含有Ni,还含有Al(31%)、Fe(1.3%)的单质及氧化物,其他不溶杂质(3.3%).部分阳离子以氢氧化物形式完全沉淀时的pH如下:
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
| pH | 5.2 | 3.2 | 9.7 | 9.2 |
(1)“碱浸”的目的是除去______.
(2)“酸浸”时所加入的酸是______(填化学式).酸浸后,滤液②中可能含有的金属离子是______.
(3)“调pH为2~3”的目的是______.
(4)产品晶体中有时会混有少量绿矾(FeSO4?7H2O),可能是由于生产过程中______.
(5)NiSO4在强碱溶液中用NaClO氧化,可制得碱性镍镉电池电极材料--NiOOH.该反应的离子方程式是______.
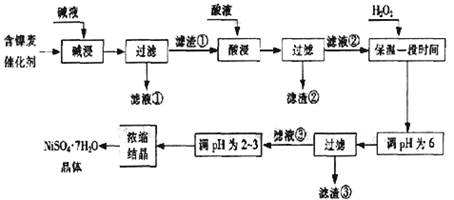
从含镍废催化剂中可回收镍,其流程如下:
某油脂化工厂的含镍催化剂主要含有Ni,还含有Al(31%)、Fe(1.3%)的单质及氧化物,其他不溶杂质(3.3%)。部分阳离子以氢氧化物形式完全沉淀时的pH如下:
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
| pH | 5.2 | 3.2 | 9.7 | 9.2 |
回答下列问题:
(1)“碱浸”的目的是除去 。
(2)“酸浸”时所加入的酸是 (填化学式)。酸浸后,滤液②中可能含有的金属离子是 。
(3)“调节pH为2~3”的目的是 。
(4)产品晶体中有时会混有少量绿矾(FeSO4?7H2O),可能是由于生产过程中
导致Fe2+未被完全氧化造成的。
(5)NiSO4在强碱溶液中用NaClO氧化,可制得碱性镍镉电池电极材料――NiOOH。该反应的离子方程式是 。
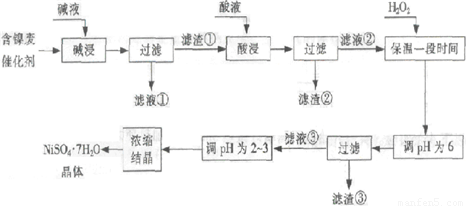
从含镍废催化剂中可回收镍,其流程如下:
某油脂化工厂的含镍催化剂主要含有Ni,还含有Al(31%)、Fe(1.3%)的单质及氧化物,其他不溶杂质(3.3%).部分阳离子以氢氧化物形式完全沉淀时的pH如下:
回答下列问题:
(1)“碱浸”的目的是除去______.
(2)“酸浸”时所加入的酸是______(填化学式).酸浸后,滤液②中可能含有的金属离子是______.
(3)“调pH为2~3”的目的是______.
(4)产品晶体中有时会混有少量绿矾,可能是由于生产过程中______.
(5)NiSO4在强碱溶液中用NaClO氧化,可制得碱性镍镉电池电极材料--NiOOH.该反应的离子方程式是______.

某油脂化工厂的含镍催化剂主要含有Ni,还含有Al(31%)、Fe(1.3%)的单质及氧化物,其他不溶杂质(3.3%).部分阳离子以氢氧化物形式完全沉淀时的pH如下:
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
| pH | 5.2 | 3.2 | 9.7 | 9.2 |
(1)“碱浸”的目的是除去______.
(2)“酸浸”时所加入的酸是______(填化学式).酸浸后,滤液②中可能含有的金属离子是______.
(3)“调pH为2~3”的目的是______.
(4)产品晶体中有时会混有少量绿矾,可能是由于生产过程中______.
(5)NiSO4在强碱溶液中用NaClO氧化,可制得碱性镍镉电池电极材料--NiOOH.该反应的离子方程式是______.