题目内容
【题目】请按指定要求完成下列问题。
(1)在3BrF3+5H2O=HBrO3+Br2+9HF+O2↑的反应中,3mol的BrF3参加反应时,被水还原的BrF3的物质的量是___。
(2)已知砒霜As2O3与Zn可发生如下反应:As2O3+6Zn+6H2SO4=2AsH3↑+6ZnSO4+3H2O
①请用双线桥法标出电子转移的方向和数目___。
②若生成0.2molAsH3,则转移的电子数为___。
(3)二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂,制备ClO2有以下两种方法:
方法一:2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O
方法二:2NaClO3+H2O2+H2SO4=2ClO2↑+O2↑+Na2SO4+2H2O
①方法一中氧化剂与还原剂的物质的量之比为___。
②若两种方法制备得到相同条件下相同体积的ClO2气体,则两种方法中消耗的还原剂质量之比是___。
③Cl2与ClO2均用作水处理剂,若它们中的氯元素均被还原为Cl-,则相同质量的ClO2是Cl2消毒效率的___倍(消毒效率:等质量两种物质所转移电子的物质的量之比)。
【答案】![]() mol
mol  1.2NA 1:1 73:34 2.63
1.2NA 1:1 73:34 2.63
【解析】
(1)在3BrF3+5H2O=HBrO3+Br2+9HF+O2↑的反应中,3mol的BrF3参加反应时,有5molH2O参加反应,失去电子4mol,在BrF3中,1molBrF3得到3mol电子,则被水还原的BrF3的物质的量是![]() mol。答案为:
mol。答案为:![]() mol
mol
(2)①反应As2O3+6Zn+6H2SO4=2AsH3↑+6ZnSO4+3H2O中,As的化合价由+3价降至-3价,Zn的化合价由0价升至+2价,用双线桥法标出电子转移的方向和数目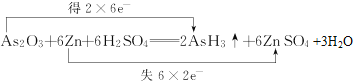 。
。
答案为:
②生成2molAsH3转移12mol电子,若生成0.2molAsH3,则转移的电子数为1.2mol ×NA=1.2NA。答案:1.2NA
(3)①方法一中氧化剂NaClO3与还原剂HCl(4molHCl参与反应,只有2mol表现出还原性,被氧化)的物质的量之比为2:2=1:1。答案为:1:1
②若两种方法制备得到相同条件下相同体积的ClO2气体,假设为2mol ClO2,则前者消耗还原剂HCl 2mol,后者消耗还原剂H2O2 1mol,质量之比是(2mol×36.5g/mol):(1mol×34g/mol)=73:34。答案为73:34
③设Cl2与ClO2的质量均为mg
Cl2 ~ 2Cl- ~ 2e- ClO2 ~ Cl- ~ 5e-
71g 2mol 67.5g 5mol
mg ![]() mg
mg ![]()
则相同质量的ClO2是Cl2消毒效率的倍数为: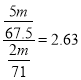
答案为:2.63。

 黄冈创优卷系列答案
黄冈创优卷系列答案