题目内容
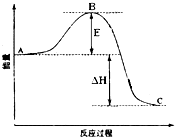 2SO2(g)+O2(g)=2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3的△H=-99kJ?mol-1.请回答下列问题:
2SO2(g)+O2(g)=2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3的△H=-99kJ?mol-1.请回答下列问题:(1)图中E的大小对该反应的反应热有无影响?
(2)已知单质硫16g燃烧放热为149KJ写出硫燃烧热的热化学方程式
(3)计算由S(s)生成3molSO3(g)的△H
分析:(1)反应物总能量大于生成物总能量,为放热反应,加入催化剂,活化能减小,反应反应热不变;
(2)根据燃烧热概念分析书写热化学方程式;
(3)利用盖斯定律计算.
(2)根据燃烧热概念分析书写热化学方程式;
(3)利用盖斯定律计算.
解答:解:(1)因图中A、C分别表示反应物总能量、生成物总能量,B为活化能,反应热可表示为A、C活化能的大小之差,活化能的大小与反应热无关,加入催化剂,活化能减小,反应反应热不变,
故答案为:无;降低;
(2)依据燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量,硫燃烧热的热化学方程式为,单质硫16g燃烧放热为149KJ,32g硫完全燃烧放热298KJ,热化学方程式为:S(s)+O2(g)=SO2(g)△H=-298KJ/mol,故答案为:S(s)+O2(g)=SO2(g)△H=-298KJ/mol;
(3)(5)已知①S(s)+O2(g)=SO2(g)△H1=-296 KJ?mol-1,②SO2(g)+
O2(g)=SO3(g)△H2=-99 KJ?mol-1;
则利用盖斯定律将①×3+②×3可得3 S(s)+
O2(g)=3SO3(g)△H3=3×(△H1+△H2)=-1185 KJ?mol-1,
故答案为:-1185 KJ?mol-1.
故答案为:无;降低;
(2)依据燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量,硫燃烧热的热化学方程式为,单质硫16g燃烧放热为149KJ,32g硫完全燃烧放热298KJ,热化学方程式为:S(s)+O2(g)=SO2(g)△H=-298KJ/mol,故答案为:S(s)+O2(g)=SO2(g)△H=-298KJ/mol;
(3)(5)已知①S(s)+O2(g)=SO2(g)△H1=-296 KJ?mol-1,②SO2(g)+
| 1 |
| 2 |
则利用盖斯定律将①×3+②×3可得3 S(s)+
| 9 |
| 2 |
故答案为:-1185 KJ?mol-1.
点评:本题综合考查反应热与焓变,为高考常见题型,侧重于学生的分析能力和计算能力的考查,注意催化剂对反应的影响以及盖斯定律的应用.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 (2009?丹东模拟)请根据工业制硫酸的有关知识回答下列问题:
(2009?丹东模拟)请根据工业制硫酸的有关知识回答下列问题:

