题目内容
 (2009?丹东模拟)请根据工业制硫酸的有关知识回答下列问题:
(2009?丹东模拟)请根据工业制硫酸的有关知识回答下列问题:(1)黄铁矿在沸腾炉中反应的化学方程式为
4FeS2+11O2
2Fe2O3+8SO2
| ||
4FeS2+11O2
2Fe2O3+8SO2
;
| ||
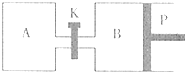
(2)在硫酸工业生产中,为了有利于SO2的转化,且能充分利用热能,采用了中间有热交换器的接触室(见图).按此密闭体系中气体的流向,则在R处流出的气体中除N2外的主要组成为
C
C
(填序号);A.SO2
B.SO2、SO3
C.SO2、O2
D.SO2、O2、SO3
(3)接触法制硫酸过程中,反应2SO2(g)+O2(g)
| ||
| △ |
AB
AB
(注:T2>T1、P2>P1,填序号);
(4)下图是工业制硫酸尾气的综合利用,气体M回收后可进入接触室循环生产,请根据图示判断X是(填名称)
氨水
氨水
,写出Y与硫酸反应生成M的化学方程式(NH4)2SO3+H2SO4═(NH4)2SO4+H2O+SO2↑
(NH4)2SO3+H2SO4═(NH4)2SO4+H2O+SO2↑
.
分析:(1)依据工业制硫酸的工艺流程分析判断,铁矿石在沸腾炉中燃烧生成二氧化硫和氧化铁,接触室中二氧化硫催化氧化为三氧化硫,吸收塔中吸收三氧化硫生成硫酸;
(2)热交换器中是利用反应放热给二氧化硫、氧气加热后在催化剂表面反应生成三氧化硫;
(3)分析图象,结合平衡移动原理分析判断;
(4)硫酸尾气主要是二氧化硫气体,依据流程尾气被X吸收生成Y,Y与硫酸反应生成氮肥推断Y为铵盐,和二氧化硫反应生成铵盐的X是氨水.
(2)热交换器中是利用反应放热给二氧化硫、氧气加热后在催化剂表面反应生成三氧化硫;
(3)分析图象,结合平衡移动原理分析判断;
(4)硫酸尾气主要是二氧化硫气体,依据流程尾气被X吸收生成Y,Y与硫酸反应生成氮肥推断Y为铵盐,和二氧化硫反应生成铵盐的X是氨水.
解答:解:(1)铁矿石在沸腾炉中燃烧生成二氧化硫和氧化铁,反应的化学方程式为:4FeS2+11O2
2Fe2O3+8SO2,故答案为:4FeS2+11O2
2Fe2O3+8SO2;
(2)充分利用热能,使反应放出的热量通过热交换器传给通入的二氧化硫和空气,在催化剂表面反应,所以R处流出的气体中除N2外的主要组成为二氧化硫和氧气,
故答案为:C;
(3)反应2SO2(g)+O2(g)
2SO3(g)△H<0;反应前后气体体积减小,反应是放热反应,T2>T1、P2>P1,依据化学平衡移动原理分析选项;
A、先拐先平,温度高达到平衡需要的时间短,符合T2>T1,纵轴是二氧化硫的转化率,反应放热,温度越高平衡逆向进行,二氧化硫转化率减小,故A正确;
B、图象中定一议二,压强一定,温度越高,平衡逆向进行,三氧化硫的含量越少;温度一定,压强越大,平衡正向进行,三氧化硫含量越大,图象符合要求,故B正确;
C、T2>T1,温度升高,速率增大,正逆反应速率都增大,平衡逆向进行,图象中正反应速率错误,故C错误;
D、压强越大速率越大,反应是气体体积减小的反应,正反应速率增大的比逆反应速率增大的多,平衡正向进行,故D错误;
故答案为:AB;
(4)硫酸尾气主要是二氧化硫气体,依据流程关系,尾气被X吸收生成Y,Y与硫酸反应生成氮肥推断Y为铵盐,所以和二氧化硫反应生成铵盐的X是氨水;生成的Y为亚硫酸铵或亚硫酸氢铵,反应的化学方程式为:(NH4)2SO3+H2SO4═(NH4)2SO4+H2O+SO2↑,故答案为:氨水;(NH4)2SO3+H2SO4═(NH4)2SO4+H2O+SO2↑.
| ||
| ||
(2)充分利用热能,使反应放出的热量通过热交换器传给通入的二氧化硫和空气,在催化剂表面反应,所以R处流出的气体中除N2外的主要组成为二氧化硫和氧气,
故答案为:C;
(3)反应2SO2(g)+O2(g)
| ||
| △ |
A、先拐先平,温度高达到平衡需要的时间短,符合T2>T1,纵轴是二氧化硫的转化率,反应放热,温度越高平衡逆向进行,二氧化硫转化率减小,故A正确;
B、图象中定一议二,压强一定,温度越高,平衡逆向进行,三氧化硫的含量越少;温度一定,压强越大,平衡正向进行,三氧化硫含量越大,图象符合要求,故B正确;
C、T2>T1,温度升高,速率增大,正逆反应速率都增大,平衡逆向进行,图象中正反应速率错误,故C错误;
D、压强越大速率越大,反应是气体体积减小的反应,正反应速率增大的比逆反应速率增大的多,平衡正向进行,故D错误;
故答案为:AB;
(4)硫酸尾气主要是二氧化硫气体,依据流程关系,尾气被X吸收生成Y,Y与硫酸反应生成氮肥推断Y为铵盐,所以和二氧化硫反应生成铵盐的X是氨水;生成的Y为亚硫酸铵或亚硫酸氢铵,反应的化学方程式为:(NH4)2SO3+H2SO4═(NH4)2SO4+H2O+SO2↑,故答案为:氨水;(NH4)2SO3+H2SO4═(NH4)2SO4+H2O+SO2↑.
点评:本题考查了工业制硫酸的流程和生产装置的应用,化学平衡影响因素的分析判断,尾气处理的方法,题目难度中等.

练习册系列答案
相关题目


 (2009?丹东模拟)甲醇可以与水蒸气反应生成氢气,反应方程式如下:
(2009?丹东模拟)甲醇可以与水蒸气反应生成氢气,反应方程式如下: