题目内容
【题目】亚硝酰氯(ClNO)常用作催化剂和合成洗涤剂,某学习小组在实验室中用下图所示装置制备ClNO。查阅资料:亚硝酰氯(ClNO)的熔点为-64.5℃、沸点为-5.5℃,气态呈黄色,液态时呈红褐色,遇水易反应生成一种氢化物和两种氮的常见氧化物,其中一种呈红棕色。

回答下列问题:
(1)仪器a的名称为________,b的作用是________。
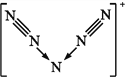
(2)ClNO分子中各原子均满足8电子稳定结构,则ClNO的电子式为__________;ClNO与水反应的化学方程式为__________。
(3)实验开始时,先打开K1、K2,关闭K3,再打开分液漏斗活塞滴入适量稀硝酸,当观察到C中_________________时关闭K1、K2;向装置D三颈瓶中通入干燥纯净Cl2,当瓶中充满黄绿色气体时,再打开K1、K3,制备ClNO,D中发生的反应方程式为________。
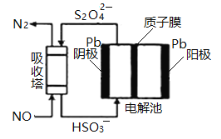
(4)NO可用间接电化学法除去,其原理如下图所示。电解池阴极的电极反应式为________;吸收塔内发生的离子方程式为_______。
(5)亚硝酰氯(ClNO)纯度的测定:将所得亚硝酰氯(ClNO)产品13.10g溶于水,配制成250mL溶液;取出25.00mL,以K2CrO4溶液为指示剂,用0.87mol·L-1AgNO3标准溶液滴定至终点,消耗标准溶液的体积为 20.00mL。(已知:Ag2CrO4为砖红色固体),则亚硝酰氯(ClNO)的质量分数为________。
【答案】长颈漏斗 防止空气中的水蒸气进入三颈烧瓶,以免ClNO发生水解 ![]() 2ClNO+H2O=2HCl+NO+NO2 红棕色完全消失 Cl2+2NO=2ClNO 2
2ClNO+H2O=2HCl+NO+NO2 红棕色完全消失 Cl2+2NO=2ClNO 2![]() +2e-+2H+=
+2e-+2H+=![]() +2H2O 2NO+2
+2H2O 2NO+2![]() +2H2O=N2+4
+2H2O=N2+4![]() 87%
87%
【解析】
本实验的目的是制备ClNO,该物质易与水反应,所以制备过程要保持干燥;装置A中利用铜和稀硝酸反应生成NO,装置B中盛水可以除去可能产生的NO2,装置C对NO进行干燥,之后进入装置D中与干燥纯净氯气在冰盐水浴条件下反应生成ClNO,b装置可以防止空气中的水蒸气进入反应装置是ClNO水解;实验时,需先打开K1、K2,关闭K3,再打开分液漏斗活塞滴入适量稀硝酸,利用产生的NO将装置中的空气排尽,NO易被氧气氧化成NO2,当观察到C中红棕色气体NO2完全消失后说明装置中空气被排尽,此时装置中充满NO;此时关闭K1、K2,向装置D三颈瓶中通入干燥纯净Cl2,当瓶中充满黄绿色气体时,再打开K1、K3,制备ClNO。
(1)根据仪器a的结构特点可知其为长颈漏斗;装置b可以防止空气中的水蒸气进入三颈烧瓶,以免ClNO发生水解;
(2)ClNO分子中各原子均满足8电子稳定结构,说明Cl与其他原子共用一对电子,N与其他原子共用3对电子,O与其他原子共用2对电子,所以电子式为![]() ;ClNO遇水易反应生成一种氢化物和两种氮的常见氧化物,其中一种呈红棕色,说明其中一种为NO2,另一种应为NO,氢化物为HCl,根据元素守恒可得化学方程式为2ClNO+H2O=2HCl+NO+NO2;
;ClNO遇水易反应生成一种氢化物和两种氮的常见氧化物,其中一种呈红棕色,说明其中一种为NO2,另一种应为NO,氢化物为HCl,根据元素守恒可得化学方程式为2ClNO+H2O=2HCl+NO+NO2;
(3)根据分析可知当观察到C中红棕色完全消失时关闭K1、K2;D中为Cl2与NO反应生成ClNO的反应,化学方程式为Cl2+2NO=2ClNO;
(4)据图可知阴极![]() 得电子发生还原反应生成
得电子发生还原反应生成![]() ,根据电荷守恒可得电极反应式为
,根据电荷守恒可得电极反应式为![]() +2e-+2H+=
+2e-+2H+=![]() +2H2O;吸收塔内
+2H2O;吸收塔内![]() 将NO还原为N2,自身被还原为
将NO还原为N2,自身被还原为![]() ,根据电子守恒可得离子方程式为2NO+2
,根据电子守恒可得离子方程式为2NO+2![]() +2H2O=N2+4
+2H2O=N2+4![]() ;
;
(5)亚硝酰氯溶于水可以产生氯离子,氯离子和银离子发生反应:Clˉ+Ag+=AgCl,滴定终点氯离子完全反应,银离子与CrO![]() 生成砖红色沉淀,根据元素守恒25.00mL溶液中n(ClNO)=n(Clˉ)=n(Ag+)=0.87mol/L×0.02L=0.0174mol,则样品中n(ClNO)=0.0174mol×
生成砖红色沉淀,根据元素守恒25.00mL溶液中n(ClNO)=n(Clˉ)=n(Ag+)=0.87mol/L×0.02L=0.0174mol,则样品中n(ClNO)=0.0174mol×![]() =0.174mol,所以纯度为
=0.174mol,所以纯度为![]() =87%。
=87%。