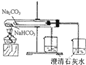
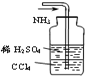
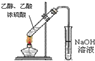
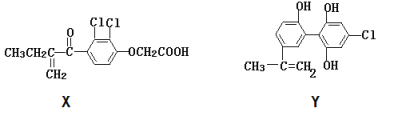
题目内容
【题目】五氧化二氮是白色固体,熔点为30℃,升温时易液化和气化,并发生以下两个相互联系的反应:①N2O5(g)![]() N2O3(g)+O2(g)②N2O3(g)
N2O3(g)+O2(g)②N2O3(g)![]() N2O(g)+O2(g)在0.5L密闭容器中,将2.5molN2O5加热气化,并按上述①②两式分解,在某温度下达到平衡,测得O2的平衡浓度为4.4mol/L,N2O3的平衡浓度1.6mol/L,则下列各项判断正确的是( )
N2O(g)+O2(g)在0.5L密闭容器中,将2.5molN2O5加热气化,并按上述①②两式分解,在某温度下达到平衡,测得O2的平衡浓度为4.4mol/L,N2O3的平衡浓度1.6mol/L,则下列各项判断正确的是( )
A.N2O5的转化率为60%
B.平衡时N2O3的物质的量为0.7mol
C.N2O5的平衡浓度为3.0mol/L
D.N2O的平衡浓度为4.4mol/L
【答案】A
【解析】
设反应①生成氧气的物质的量是amol、反应②生成氧气的物质的量是bmol;
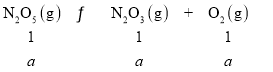
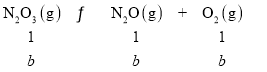
则a+b=2.2mol,a-b=0.8mol,所以a=1.5mol、b=0.7mol。
A.参加反应的N2O5的物质的量是1.5mol,N2O5转化率为![]() ,故A正确;
,故A正确;
B.平衡时N2O3的物质的量为1.6mol/L ×0.5L=0.8mol,故B错误;
C.N2O5的平衡浓度为![]() mol/L,故C错误;
mol/L,故C错误;
D.N2O的平衡浓度为![]() mol/L,故D错误;
mol/L,故D错误;

 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案【题目】下表中对应关系错误的是( )
A | NaCl=Na++Cl-; NH3·H2O | 均属于电离方程式 |
B | Ba2++SO HCO | 均可表示一类反应 |
C | SO2使酸性高锰酸钾溶液褪色; SO2使碱性酚酞溶液褪色 | 均利用SO2的同一性质 |
D | Cl2+2NaOH=NaCl+NaClO+H2O; 3S+6NaOH=2Na2S+Na2SO3+3H2O | Cl2和S在反应中既作氧化剂又作还原剂 |
A.AB.BC.CD.D
【题目】某![]() 待测溶液中除含有
待测溶液中除含有![]() 的
的![]() 外,还可能含有下列离子中的一种或多种:
外,还可能含有下列离子中的一种或多种:
阳离子 |
|
阴离子 |
|
现讲行如下实验操作![]() 每次实验所加试剂均过量
每次实验所加试剂均过量![]()
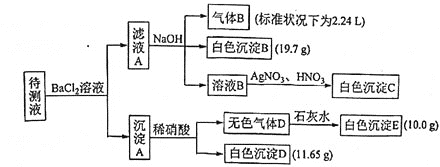
下列说法不正确的是
A.向溶液B中加![]() 与
与![]() 的操作是多余的,待测液中一定含有的离子是
的操作是多余的,待测液中一定含有的离子是![]() 、
、![]() 、
、![]() 、
、![]() ,且
,且![]()
B.生成白色沉淀B的离子方程式为
C.已知白色沉淀C能溶于浓氨水,离子方程式为![]()
D.若无色气体D是混合气体,则沉淀A的成分可能是![]() 、
、![]() 、
、![]()