题目内容
20.已知五种短周期元素的原子半径及主要化合价如表:| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.089 | 0.074 |
| 主要化合价 | +2 | +3 | +6、-2 | +2 | -2 |
| A. | A、B的单质与盐酸反应的速率:B>A | B. | B的氧化物具有两性 | ||
| C. | C和E在常温下可发生化学反应 | D. | A和E能形成共价化合物 |
分析 A和D的化合价都为+2价,应为周期表第ⅡA族,根据半径关系可知D为Be,A为Mg,C和E的化合价都有-2价,应为周期表第ⅥA族元素,C的最高价为+6价,应为S元素,E无正价,应为O元素,B的化合价为+3价,应为周期表第ⅢA族元素,根据半径大于S,为Al元素,结合元素周期律知识解答该题.
解答 解:由以上分析可知A为Mg、B为Al、C为S、D为Be、E为O元素.
A.金属性Mg>Al,金属镁与盐酸反应速率较大,故A错误;
B.B为Al,对应的氧化物既可与酸反应也可与碱反应,为两性氧化物,故B正确;
C.常温下硫和氧气不反应,应在点燃条件下进行,故C错误;
D.氧化镁为离子化合物,故D错误.
故选B.
点评 本题考查元素位置结构性质的关系及应用,为高频考点,侧重考查学生的分析能力,题目难度中等,准确把握元素化合价、原子半径与元素的关系是解题关键.

练习册系列答案
 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案
相关题目
11.从柑橘中可提炼得1,8萜二烯( ).下列有关它的说法不正确的是( )
).下列有关它的说法不正确的是( )
 ).下列有关它的说法不正确的是( )
).下列有关它的说法不正确的是( )| A. | 分子式为C10H16 | B. | 分子中所有碳原子可能共平面 | ||
| C. | 其一氯代物有9种 | D. | 能与溴水发生加成反应 |
15.下列物质在水溶液中,存在电离平衡的是( )
| A. | Ca(OH)2 | B. | H2S | C. | BaSO4 | D. | CH3COONa |
12.在100g炭不完全燃烧所得气体中CO和CO2的体积比为1:2.已知:
C(s)+$\frac{1}{2}$O2(g)═CO(g)△H1=-110.35kJ/mol
CO(g)+$\frac{1}{2}$O2═CO2(g)△H2=-282.57kJ/mol
则与100g炭完全燃烧相比,损失的热量是( )
C(s)+$\frac{1}{2}$O2(g)═CO(g)△H1=-110.35kJ/mol
CO(g)+$\frac{1}{2}$O2═CO2(g)△H2=-282.57kJ/mol
则与100g炭完全燃烧相比,损失的热量是( )
| A. | 392.93 kJ | B. | 2 489.42 kJ | C. | 784.92 kJ | D. | 3 274.3 kJ |
19.下列过程与配合物的形成无关的是( )
| A. | 向一定量的AgNO3溶液中加入氨水至沉淀消失 | |
| B. | 向一定量的AlCl3中滴加NaOH直到沉淀消失 | |
| C. | 向一定量的CuSO4溶液中加入氨水至沉淀消失 | |
| D. | 向FeCl3溶液中加入KSCN溶液 |
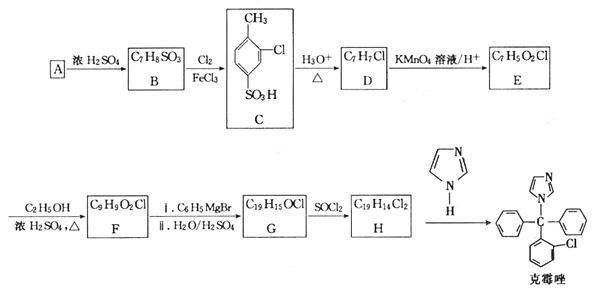

 .
. +Cl2$\stackrel{FeCl_{3}}{→}$
+Cl2$\stackrel{FeCl_{3}}{→}$ +HCl.
+HCl. 、
、 .
. 的合成路线.
的合成路线. 是一种有机烯醚,可以用烃A通过下列路线获得A$→_{①}^{Br_{2}/CCl}$B$→_{②}^{NaOH水溶液/△}$C$→_{③}^{浓H_{2}SO_{4}/△}$
是一种有机烯醚,可以用烃A通过下列路线获得A$→_{①}^{Br_{2}/CCl}$B$→_{②}^{NaOH水溶液/△}$C$→_{③}^{浓H_{2}SO_{4}/△}$ 的同分异构体的结构简式(写出2种)HC≡CCH2CH2OH、CH3C≡CCH2OH
的同分异构体的结构简式(写出2种)HC≡CCH2CH2OH、CH3C≡CCH2OH 4-甲基-3-乙基-2-己烯;
4-甲基-3-乙基-2-己烯;  2,2,3-三甲基戊烷;
2,2,3-三甲基戊烷; 1,4-二乙基苯.
1,4-二乙基苯. .
.