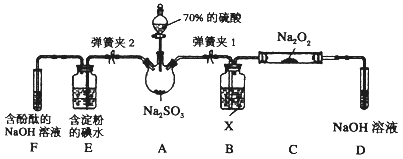
题目内容
【题目】X、Y、Z、W、T是原子序数依次増大的五种短周期元素,且X、Y、Z、W的原子序数之和为32。其中X是元素周期表中原子半径最小的元素,Y、Z左右相邻,Z、W位于同一主族。T的单质常用于自来水的杀菌消毒。
请回答下列问题:
(1)W元素在周期表中的位置为:____________________
(2)由 X、Y、Z、W四种元素中的三种组成一种强酸,该强酸的稀溶液能与金属铜反应,该反应的离子方程式为____________________。
(3)Y元素的气态氢化物与其最高价氧化物的水化物可以相互反应,写出其离子方程式:______________
(4)Y和T两元素的非金属性强弱为Y________T (填“>”“<”或者“=”)。可以验证该结论的方法是___________________
A.比较这两种元素的气态氢化物的沸点
B.比较这两种元素所形成含氧酸的酸性
C.比较这两种元素的气态氢化物的稳定性
D.比较这两种元素与氢气化合的难易程度
E.比较这两种元素气态氢化物的还原性
(5)某化学兴趣小组欲通过实验探究元素N、C、Si 非金属性强弱。实验装置如下:
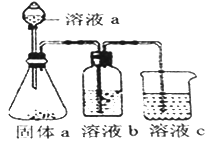
①溶液a和溶液b分别为__________溶液、________溶液(填溶质化学式)
②经验证,N、C、Si的非金属性由强到弱为:__________
【答案】 第三周期第VIA族 3Cu + 8H+ +2NO3- = 3Cu2+ +2NO↑ +4H2O NH3 + H+=NH4+ < CDE HNO3 NaHCO3 N>C>Si
【解析】根据元素的原子序数相对大小、数量关系,然后结合元素在周期表中的相对位置以及有关元素的性质判断出元素种类,最后结合对应单质、化合物的性质以及元素周期律的递变规律逐一分析解答。
X是元素周期表中原子半径最小的元素,应为H元素,Y、Z左右相邻,Z、W位于同一主族,且原子序数依次增大,可设Z的原子序数为a,则Y的原子序数为a-1,W的原子序数为a+8,故有1+a+a-1+a+8=32,a=8,因此Y、Z、W分别为N、O、S元素,T的单质常用于自来水的杀菌消毒,提纯T是Cl。
(1)S元素的原子序数是16,在周期表中的位置为第三周期第VIA族;(2)由 X、Y、Z、W四种元素中的三种组成一种强酸,该强酸的稀溶液能与金属铜反应,该强酸是稀硝酸,反应的离子方程式为3Cu + 8H+ +2NO3- =3Cu2+ +2NO↑ +4H2O;(3)N元素的气态氢化物与其最高价氧化物的水化物可以相互反应生成硝酸铵,其离子方程式为NH3 + H+=NH4+;(4)氯元素的非金属性强于氮元素,A.非金属性强弱与元素的气态氢化物的沸点无关,A错误;B.非金属性越强,最高价含氧酸的酸性越强,因此比较这两种元素所形成含氧酸的酸性不能比较非金属性强弱,B错误;C.非金属性越强,氢化物越稳定,因此比较这两种元素的气态氢化物的稳定性可以比较非金属性强弱,C正确;D.非金属性越强,越容易与氢元素化合,因此比较这两种元素与氢气化合的难易程度可以比较非金属性强弱,D正确;E.非金属性越强,相应阴离子的还原性越弱,因此比较这两种元素气态氢化物的还原性可以比较非金属性强弱,E正确,答案选CDE;(5)①要通过实验探究元素N、C、Si 非金属性强弱,可以依据较强酸制备较弱酸完成。即利用硝酸与碳酸盐反应生成CO2,CO2通入硅酸钠溶液中,由于硝酸易挥发,生成的CO2中混有硝酸气体,所以溶液a和溶液b分别为HNO3溶液、饱和NaHCO3溶液;②经验证,N、C、Si的非金属性由强到弱为N>C>Si。

 字词句段篇系列答案
字词句段篇系列答案【题目】某温度下,0.200 molL-1的HA溶液与0.200 molL-1的NaOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如下表,下列说法正确的是
微粒 | X | Y | Na+ | A- |
浓度/(mol·L-1) | 8.00 | 2.50 | 0.100 | 9.92 |
A. 0.1mol·L-1HA溶液的pH=1 B. 该温度下Kw=1.0![]() 10-14
10-14
C. 微粒X表示OH-,Y表示H+ D. 混合溶液中:n(A-)+n(X)=n(Na+)