题目内容
【题目】(7分)下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素。
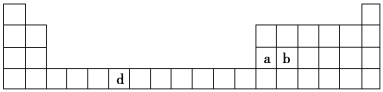
(1)请写出元素d的基态原子电子排布式________________________________________。
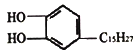
(2)b元素的氧化物中b与氧元素之间的共价键类型是________。其中b原子的杂化方式是_______。
(3)a单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。
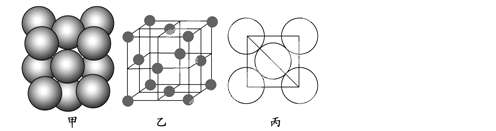
若已知a的原子半径为d,NA代表阿伏加德罗常数,a的相对原子质量为M,则一个晶胞中a原子的数目为________,该晶体的密度为________(用字母表示)。
【答案】(1) 1s22s22p63s23p63d54s1 (2)σ键或极性共价键 SP3杂化 (3)4 ![]()
【解析】
试题分析:
(1)根据洪特规则的特例,d轨道半充满时更稳定,其电子排布式是1s22s22p63s23p63d54s1
而不是1s22s22p63s23p63d44s2。
(2)SiO2中硅氧之间的共价键是“头对头”的方式,所以是σ键,其中Si的杂化方式是SP3杂化。
(3)由分摊法计算:8×![]() +6×
+6×![]() =4;该晶胞的质量m=
=4;该晶胞的质量m=![]() ,该晶胞的边长为:2
,该晶胞的边长为:2![]() d,体积V=(2
d,体积V=(2![]() d)3=16
d)3=16![]() d3,晶胞密度ρ=m/V=
d3,晶胞密度ρ=m/V=![]()

练习册系列答案
相关题目