题目内容
【化学—选修2:化学与技术】(15分)
工业上采用电解饱和食盐水的方法生产烧碱和氯气。
Ⅰ.电解饱和食盐水之前,需精制食盐水。为了除去粗盐中的Ca2+、Mg2+、SO42-、及泥沙,可将粗盐溶于水,然后进行下列五项操作:①过滤;②加过量NaOH溶液;③加适量盐酸;④加过量Na2CO3溶液;⑤加过量BaCl2溶液。正确的操作顺序是 。
Ⅱ.氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上。在这种工艺设计中,相关物料的传输与转化关系如图所示,其中的电极未标出,所用的离子膜都只允许阳离子通过。
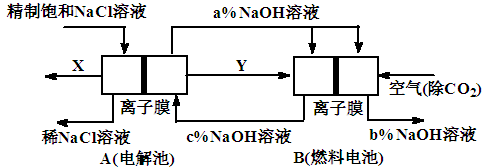
⑴图中X、Y分别是_____、______(填化学式)
⑵分别写出燃料电池B中正极、负极上发生的电极反应
正极:___________ __; 负极:___________ ____;
⑶为什么必须将空气中的二氧化碳除去才能通入燃料电池? 。
⑷分析比较图示中氢氧化钠质量分数a%、b%和c%的大小 。
工业上采用电解饱和食盐水的方法生产烧碱和氯气。
Ⅰ.电解饱和食盐水之前,需精制食盐水。为了除去粗盐中的Ca2+、Mg2+、SO42-、及泥沙,可将粗盐溶于水,然后进行下列五项操作:①过滤;②加过量NaOH溶液;③加适量盐酸;④加过量Na2CO3溶液;⑤加过量BaCl2溶液。正确的操作顺序是 。
| A.④②①⑤③ | B.④①②⑤③ | C.②⑤④①③ |
| D.②④⑤①③ E.⑤②④①③ F.⑤④②①③ |

⑴图中X、Y分别是_____、______(填化学式)
⑵分别写出燃料电池B中正极、负极上发生的电极反应
正极:___________ __; 负极:___________ ____;
⑶为什么必须将空气中的二氧化碳除去才能通入燃料电池? 。
⑷分析比较图示中氢氧化钠质量分数a%、b%和c%的大小 。
Ⅰ.CEF(3分)
Ⅱ.⑴Cl2(2分)、H2(2分)⑵O2+2H2O+4e-=4OH-(2分);H2-2e-+2OH-=2H2O(2分)⑶使燃料电池导出的NaOH溶液中混有Na2CO3(2分)⑷b%>a%>c%(2分)
Ⅱ.⑴Cl2(2分)、H2(2分)⑵O2+2H2O+4e-=4OH-(2分);H2-2e-+2OH-=2H2O(2分)⑶使燃料电池导出的NaOH溶液中混有Na2CO3(2分)⑷b%>a%>c%(2分)
Ⅰ.考查离子的除杂。泥沙不溶于水过滤即可。Ca2+、Mg2+、SO42-对应的试剂分别是碳酸钠、氢氧化钠和氯化钡。由于过量的氯化钡要通过碳酸钠来除去,所以正确的答案选CEF。
Ⅱ.(1)惰性电极电解氯化钠溶液的生成物是氯气、氢气和氢氧化钠。由于B是燃料电池,所以Y是氢气,X是氯气。
(2)原电池中负极失去电子,正极得到电子,所以氢气在负极通入,氧气在正极通入。由于电解质是氢氧化钠,所以正负极的电极反应式分别是O2+2H2O+4e-=4OH-、2H2-4e-+4OH-=4H2O.
(3)因为CO2能和氢氧化钠反应生成碳酸钠,使燃料电池导出的NaOH溶液中混有Na2CO3。
(4)由于离子交换膜的作用,最终得到的氢氧化钠浓度增大,即b%>a%>c%。
Ⅱ.(1)惰性电极电解氯化钠溶液的生成物是氯气、氢气和氢氧化钠。由于B是燃料电池,所以Y是氢气,X是氯气。
(2)原电池中负极失去电子,正极得到电子,所以氢气在负极通入,氧气在正极通入。由于电解质是氢氧化钠,所以正负极的电极反应式分别是O2+2H2O+4e-=4OH-、2H2-4e-+4OH-=4H2O.
(3)因为CO2能和氢氧化钠反应生成碳酸钠,使燃料电池导出的NaOH溶液中混有Na2CO3。
(4)由于离子交换膜的作用,最终得到的氢氧化钠浓度增大,即b%>a%>c%。

练习册系列答案
相关题目

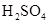 共热制取CO.
共热制取CO.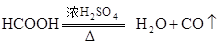
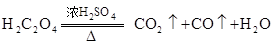
 的CO气体?
的CO气体? 的还原性谁强?
的还原性谁强?
 5Fe3++Mn2++4H2O
5Fe3++Mn2++4H2O