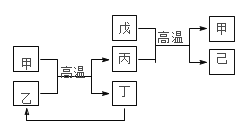
题目内容
【题目】有A、B、C、D、E 五种元素的原子序数依次增大,B、C 的阳离子与A的阴离子和氖原子的电子层结构相同;A、B可形成离子化合物B2A;C的氧化物既能与强酸反应,又能与强碱反应;D的原子结构示意图为: ;E的最外层电子数是电子层数的2倍。试回答下列各问题:
;E的最外层电子数是电子层数的2倍。试回答下列各问题:
(1)B、D元素分别为_________、_________;
(2)D元素位于元素周期表中第_______周期、第______族;
(3)化合物B2A的电子式____________________;
(4)E的最高价氧化物的水化物的分子式是________________________。
(5)D与NaOH溶液反应的化学方程式:_______________________________。
(6)C的氧化物与E的最高价氧化物的水化物溶液反应的离子方程式: ________________________________。
【答案】Na Si 三 IVA ![]() H2SO4 Si + 2NaOH + H2O = Na2SiO3+ 2H2↑ Al2O3+ 6H+= 2Al3++ 3H2O
H2SO4 Si + 2NaOH + H2O = Na2SiO3+ 2H2↑ Al2O3+ 6H+= 2Al3++ 3H2O
【解析】
A、B、C、D、E五种元素,原子序数依次增大,D的原子结构示意图为: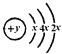 ,则x=2,所以D为硅元素;E的最外层电子数是电子层数的2倍,E为硫元素;C的氧化物既能与强酸反应,又能与强碱反应,C为铝元素;B、C的阳离子、A的阴离子均具有与氖原子相同的电子层结构,说明A位于第二周期,B、C位于第三周期,A、B可形成离子化合物B2A,且原子序数小于C,则A为-2价,B为+1价,所以A为氧元素,B为钠元素,据以上分析解答。
,则x=2,所以D为硅元素;E的最外层电子数是电子层数的2倍,E为硫元素;C的氧化物既能与强酸反应,又能与强碱反应,C为铝元素;B、C的阳离子、A的阴离子均具有与氖原子相同的电子层结构,说明A位于第二周期,B、C位于第三周期,A、B可形成离子化合物B2A,且原子序数小于C,则A为-2价,B为+1价,所以A为氧元素,B为钠元素,据以上分析解答。
A、B、C、D、E五种元素,原子序数依次增大,D的原子结构示意图为: ,则x=2,所以D为硅元素;E的最外层电子数是电子层数的2倍,E为硫元素;C的氧化物既能与强酸反应,又能与强碱反应,C为铝元素;B、C的阳离子、A的阴离子均具有与氖原子相同的电子层结构,说明A位于第二周期,B、C位于第三周期,A、B可形成离子化合物B2A,且原子序数小于C,则A为-2价,B为+1价,所以A为氧元素,B为钠元素;
,则x=2,所以D为硅元素;E的最外层电子数是电子层数的2倍,E为硫元素;C的氧化物既能与强酸反应,又能与强碱反应,C为铝元素;B、C的阳离子、A的阴离子均具有与氖原子相同的电子层结构,说明A位于第二周期,B、C位于第三周期,A、B可形成离子化合物B2A,且原子序数小于C,则A为-2价,B为+1价,所以A为氧元素,B为钠元素;
(1)由上面的分析可以知道,B为Na,D为Si;
因此,本题正确答案是:Na,Si。
(2) D为硅元素,位于元素周期表中第三周期第IVA族;
因此,本题正确答案是: 三、IVA;
(3)化合物B2A为Na2O,它的电子式为![]() ;
;
因此,本题正确答案是: ![]() ;
;
(4) 硫的最高价氧化物的水化物是硫酸,分子式是H2SO4;
综上所述,题正确答案:H2SO4;
(5)硅与NaOH溶液反应生成硅酸钠和氢气,化学方程式为:Si+2NaOH+H2O=Na2SiO3+ 2H2↑;
综上所述,本题正确答案:Si+2NaOH+H2O=Na2SiO3+ 2H2↑;
(6)C的氧化物为Al2O3,E的最高价氧化物的水化物为硫酸,二者反应生成硫酸铝和水,反应的离子方程式为:Al2O3+6H+=2Al3++3H2O;
综上所述,本题正确答案:Al2O3+ 6H+=2Al3++3H2O。

 科学实验活动册系列答案
科学实验活动册系列答案【题目】一定温度下,在三个体积均为0.5 L的恒容密闭容器中发生反应:CO(g)+Cl2(g) ![]() COCl2(g),其中容器Ⅰ中反应在5 min时达到平衡状态。
COCl2(g),其中容器Ⅰ中反应在5 min时达到平衡状态。
容器编号 | 温度/℃ | 起始物质的量/mol | 平衡物质的量/mol | ||
CO | Cl2 | COCl2 | COCl2 | ||
Ⅰ | 500 | 1.0 | 1.0 | 0 | 0.8 |
Ⅱ | 500 | 1.0 | a | 0 | 0.5 |
Ⅲ | 600 | 0.5 | 0.5 | 0.5 | 0.7 |
下列说法中正确的是
A.该反应正反应为放热反应
B.容器Ⅰ中前5 min的平均反应速率υ(CO)=0.16 mol·L-1·min-1
C.容器Ⅱ中,a=0.55 mol
D.若容器Ⅰ为恒压,达到平衡时CO转化率小于80%
【题目】某课题组设计实验探究SO2的性质。
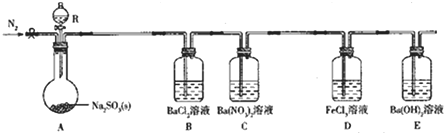
实验现象:B中无沉淀生成,C中有白色沉淀;D中溶液颜色变浅,E中产生白色沉淀。
(1)仪器R的名称是___。
(2)实验室在常温下用80%的硫酸与亚硫酸钠粉末反应制备SO2,写出A中反应的化学方程式:___。
(3)部分实验步骤如下:连接装置、检查气密性、装药品,向装置中通入一段时间N2,然后启动A中反应。“通入一段时间的N2”的目的是___。
(4)探究装置C中通入SO2的量与产物的关系。
①他们提出如下猜想:
猜想1:通入过量的SO2,则发生反应的离子方程式为Ba2++2NO3-+3SO2+2H2O=BaSO4↓+2SO42-+2NO+4H+。
猜想2:通入少量的SO2,则发生反应的离子方程式为___。
②请你帮他们设计实验证明猜想1和猜想2哪个合理,完成下列实验:
提供试剂:溴水、铜粉、Ba(NO3)2溶液、BaCl2溶液、Na2CO3溶液
实验步骤 | 实验现象及结论 |
取少量C中反应后溶液于试管中,___ | ___ |
(5)下列可检验装置D反应后溶液中是否有Fe2+的最佳试剂是___(填字母)。
a.KSCN溶液 b.NaOH溶液 c.K3[Fe(CN)6]溶液 d.KSCN溶液和双氧水
(6)常温下,实验完毕后,分离、提纯装置E中白色固体M,取适置M于试管中,滴少量盐酸(M剩余),所得溶液的pH___7(填“>”“<”或“=”)。
【题目】某化学活动小组设计如图所示(部分夹持装置已略去)实验装置,以探究潮湿的Cl2与Na2CO3反应得到的固体物质。
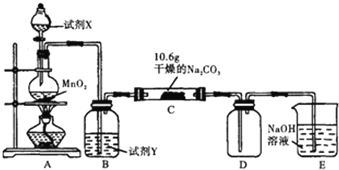
(1)装置A中发生反应的化学方程式是___。
(2)试剂Y是___;作用是___。
(3)已知:通入一定量的氯气后,测得D中有一种常温下为黄红色的气体,其为含氯的氧化物.可以确定的是C中含有氯元素的盐只有一种,且含有NaHCO3,现对C中反应后固体的成分进行猜想和探究。
提出合理假设。
假设1:存在两种成分:NaHCO3和物质W;
假设2:存在三种成分:NaHCO3、Na2CO3和物质W。
则上述假设中物质W为___(填化学式)。
设计方案,进行实验。请填写相应的实验步骤以及预期现象和结论。
限选实验试剂:稀H2SO4、稀HNO3、BaCl2溶液、Ba(OH)2溶液、AgNO3溶液。
实验步骤 | 预期现象和结论 |
步骤1:取C中的少量固体样品于试管中,滴加足量蒸馏水至固体溶解,然后将所得溶液分别置于A、B试管中 | |
步骤2:向A试管中滴加___ | ①若无明显现象,证明固体中不含___ ②若出现___(填现象和结论) |
步骤3:向B试管中滴加___ | 若溶液中出现白色沉淀,则证明含有氯元素的盐;结合步骤2中①,则假设1成立;结合步骤2中②,则假设2成立 |
(4)若假设1成立,已知C中有0.1molCl2参加反应,推知C中反应的化学方程式为___。
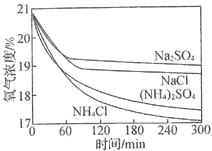
【题目】利用如下实验探究铁钉在不同溶液中的吸氧腐蚀。下列说法不正确的是
实验装置 | 实验编号 | 浸泡液 | pH | 氧气浓度随时间的变化 |
|
|
| 5 |
|
|
| 5 | ||
|
| 7 | ||
|
| 7 |
A.上述正极反应均为![]()
B.在不同溶液中,![]() 是影响吸氧腐蚀速率的主要因素
是影响吸氧腐蚀速率的主要因素
C.向实验![]() 中加入少量
中加入少量![]() 固体,吸氧腐蚀速率加快
固体,吸氧腐蚀速率加快
D.![]() 内,铁钉的平均吸氧腐蚀速率酸性溶液大于中性溶液
内,铁钉的平均吸氧腐蚀速率酸性溶液大于中性溶液