题目内容
【题目】【化学一选修3:物质结构与性质】A、B、C、D、E五种元素的原子序数依次增大。A 是原子半径最小的元素;B的最外层电子数是次外层电子数的2倍; D的L能层有两对成对电子;E+的核外有三个能层,且都外于全满状态。试回答下列问题:
(1)基态E原子核外电子的排布式为___________________。
(2)B、C、D三种元素的电负性由大到小的顺序是____________(填元素符号)。A、C、D三种元素形成的常见离子化合物中阳离子的空间构型为_____________,阴离子的中心原子轨道采用______________杂化。
(3)E(CA3)![]() 离子的颜色是___________;含有化学键类型是_____________;离子中C原子杂化轨道类型是__________________。
离子的颜色是___________;含有化学键类型是_____________;离子中C原子杂化轨道类型是__________________。
(4)D、E能形成两种晶体,其晶胞分别如甲、乙两图。晶体乙中,E的配位数为_________;在一定条件下,甲和C2A4反应生成乙,同时生成在常温下分别为气体和液体的另外两种常见无污染物质。该化学反应方程式为______________________。

(5)若甲的密度为ρ g/cm3,NA表示阿伏加德罗常数,则甲晶胞的边长可表示为_________cm。
【答案】(1)![]() ;
;
(2)O>N>C,正四面体,sp2;
(3)深蓝色,共价键、配位键,sp3;
(4)2,4CuO+N2H4![]() 2Cu2O+2H2O+N2↑;(5)
2Cu2O+2H2O+N2↑;(5)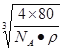
【解析】试题分析:A是原子半径最小的元素,即A为H,B的最外层是次外层电子数的2倍,即B为C,D的L层有两对成对电子,推出D为O,则C为N,E+的核外三个能层,且都处于全满状态,推出E为Cu,(1)铜位于第四周期,IB族,核外电子排布式为![]() ;(2)同周期从左向右,电负性增大,即O>N>C;构成离子化合物是NH4NO3,阳离子是NH4+,有4个σ键,孤电子对数为(5-1-4)/2=0,价层电子对数为4,因此空间构型为正四面体,阴离子是NO3-,有3个σ键,孤电子对数(5+1-3×2)/2=0.5,价层电子对数为4,杂化轨道数等于价层电子对数,即杂化类型为sp3;(3)化学式为Cu(NH3)42+,此离子显深蓝色,NH3中含有共价键,Cu2+和NH3间存在配位键,C2A4是N2H4,NH3中N的杂化类型是sp3;(4)根据乙的晶胞,Cu的配位数为2,D位于顶点:8×1/8=1,一个位于体心,D的个数为1+1=2,E位于体心,个数为4,因此化学式为Cu2O,生成无污染的气体,即N2,因此化学反应方程式为:4CuO+N2H4
;(2)同周期从左向右,电负性增大,即O>N>C;构成离子化合物是NH4NO3,阳离子是NH4+,有4个σ键,孤电子对数为(5-1-4)/2=0,价层电子对数为4,因此空间构型为正四面体,阴离子是NO3-,有3个σ键,孤电子对数(5+1-3×2)/2=0.5,价层电子对数为4,杂化轨道数等于价层电子对数,即杂化类型为sp3;(3)化学式为Cu(NH3)42+,此离子显深蓝色,NH3中含有共价键,Cu2+和NH3间存在配位键,C2A4是N2H4,NH3中N的杂化类型是sp3;(4)根据乙的晶胞,Cu的配位数为2,D位于顶点:8×1/8=1,一个位于体心,D的个数为1+1=2,E位于体心,个数为4,因此化学式为Cu2O,生成无污染的气体,即N2,因此化学反应方程式为:4CuO+N2H4![]() 2Cu2O+2H2O+N2↑;(5)甲中,Cu位于体心,真正属于晶胞的是4个,O的个数为8×1/8+2×1/2+1+4×1/4=4,甲的化学式为CuO,晶胞的质量为4×80/NAg,根据密度的定义,因此边长为
2Cu2O+2H2O+N2↑;(5)甲中,Cu位于体心,真正属于晶胞的是4个,O的个数为8×1/8+2×1/2+1+4×1/4=4,甲的化学式为CuO,晶胞的质量为4×80/NAg,根据密度的定义,因此边长为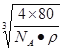 。
。

 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案