题目内容
【题目】元素周期表中第四周期元素有许多重要用途。
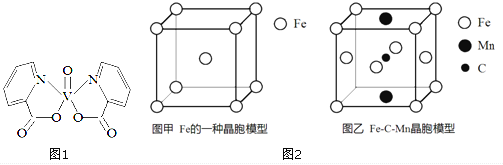
I.研究发现,钒元素的某种配合物可增强胰岛素降糖作用,它是电中性分子,结构如图1。
(1) 基态V元素的价层电子轨道表示式为___________,分子中非金属元素电负性由大到小的顺序为______________。
(2) 分子中采取sp2杂化的原子有_________,1mol 分子中含有配位键的数目是______。
(3) 该物质的晶体中除配位键外,所含微粒间作用力的类型还有______ (填序号)。
a. 金属键 b.极性键 c.非极性键 d.范德华力 e. 氢键
II.Fe 与C、Mn等元素可形成多种不同性能的合金。
(4) 图2-甲是Fe的一种晶胞,晶胞中Fe 的堆积方式为________,己知该晶体的密度为ρg·cm-3,用NA表示阿伏加德罗常数的值,则该晶胞的边长为__________cm。
(5) 图2-乙是Fe-C-Mn 合金(晶体有缺陷)的一种晶胞,则与C原子等距紧邻Fe 的个数为___,该合金的化学式为__________。
【答案】 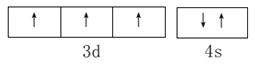 O>N>C>H C、N 2NA bcd 体心立方密堆积
O>N>C>H C、N 2NA bcd 体心立方密堆积 ![]() 4 Fe23Mn8C8
4 Fe23Mn8C8
【解析】I. (1). V是23号元素,其价层电子排布式为3d34s2,价层电子轨道表示式为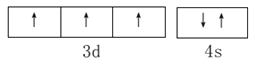 ,由图1可知,该配合物中含有N、O、C、H四种非金属元素,由元素周期律可知,这四种元素的非金属性O>N>C>H,非金属性越强,电负性越大,则电负性由大到小的顺序为:O>N>C>H,故答案为:
,由图1可知,该配合物中含有N、O、C、H四种非金属元素,由元素周期律可知,这四种元素的非金属性O>N>C>H,非金属性越强,电负性越大,则电负性由大到小的顺序为:O>N>C>H,故答案为: ;O>N>C>H;
;O>N>C>H;
(2). 由图1可知,该分子中的C原子和N原子的σ键数均为3且没有孤电子对,所以C原子和N原子的杂化轨道数目均为3,采取sp2杂化,由图1可知,V与N原子之间形成配位键,1个分子中含有2个配位键,则1mol分子中含有2mol配位键,数目为2NA,故答案为:C、N;2NA;
(3). 该物质是电中性分子,分子之间存在范德华力,由图1可知,该物质的晶体中除配位键外,分子内的不同非金属原子之间形成极性共价键,同种非金属原子之间形成非极性共价键,不存在金属键和氢键,故答案为:bcd;
II. (4). 由Fe的晶胞结构示意图可知,晶胞中Fe的堆积方式为体心立方密堆积,晶胞中Fe原子的个数为:8×![]() +1=2,则晶胞的质量为:
+1=2,则晶胞的质量为:![]() ×56g,设晶胞的棱长为x cm,则
×56g,设晶胞的棱长为x cm,则![]() ×56g=ρg·cm-3×(x cm)3,解得x=
×56g=ρg·cm-3×(x cm)3,解得x=![]() cm,故答案为:体心立方密堆积;
cm,故答案为:体心立方密堆积;![]() ;
;
(5). 由图乙可知,体心的C原子与面心的Fe原子距离最近,则与C原子等距紧邻的Fe原子个数为4,该晶胞中Fe原子个数为7×![]() +4×
+4×![]() =
=![]() ,C原子个数为1,Mn原子数目为2×
,C原子个数为1,Mn原子数目为2×![]() =1,则Fe、Mn、C原子数目之比为23:8:8,化学式为:Fe23Mn8C8,故答案为:4;Fe23Mn8C8。
=1,则Fe、Mn、C原子数目之比为23:8:8,化学式为:Fe23Mn8C8,故答案为:4;Fe23Mn8C8。
点睛:本题主要考查物质结构和性质,涉及电子排布式、电负性、杂化方式、配合物、晶胞结构和有关计算,试题难度不大。本题的易错点是第(5)小题,在利用均摊法计算晶胞中原子个数时,要注意该晶体有缺陷,即有一个顶点未排列Fe原子。
【题型】综合题 【题目】香料G的一种合成工艺如下图所示。
【结束】
12
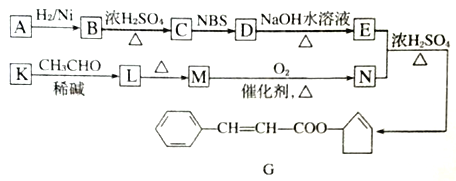
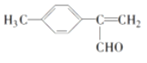
A 的分子式为C5H8O其核磁共振氢谱显示有两种峰。其峰面积之比为1: 1.
已知:CH3CH2CH=CH2![]() CH3CHBrCH=CH2
CH3CHBrCH=CH2
CH3CHO+CH3CHO![]()
![]()
![]()
![]() CH3CH=CHCHO+H2O
CH3CH=CHCHO+H2O
请回答下列问题:
(1)G中含氧官能团的名称为_______,B生成C的反应类型为_________。
(2)A的结构简式为_______。
(3)写出下列转化的化学方程式:D→E_____________________
(4)有学生建议,将M→N的转化用KMnO4(H+)代替O2,老师认为不合理,原因是_______。
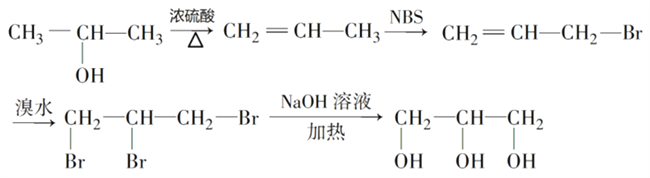
(5)F是M的同系物,比M多一个碳原子。满足下列条件的F的同分异构体有____种。(不考虑立体异构),其中核磁共振氢谱显示5组峰的结构简式为_______、________。
①能发生银镜反应 ②能与溴的四氯化碳溶液加成 ③苯环上有2个取代基
(6) 以2-丙醇和NBS试剂为原料制备甘油(丙三醇),请设计合成路线(其他无机原料任选)__________。
请用以下方式表示: ![]()
【答案】 酯基 消去反应 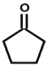
 KMnO4(H+)在氧化醛基的同时,还可以氧化碳碳双键 18
KMnO4(H+)在氧化醛基的同时,还可以氧化碳碳双键 18 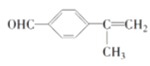
【解析】采用逆推法并结合反应条件可以得出N为![]() ,E为
,E为![]() ,所以D为
,所以D为![]() ,C为
,C为![]() ,B为
,B为![]() ,A为
,A为![]() ,M为
,M为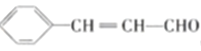 ,L为
,L为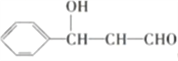 ,K为
,K为![]() 。
。
(1). 由G的结构简式可知,G中的含氧官能团为酯基,B为环戊醇、C为环戊烯,B生成C的反应类型为消去反应,故答案为:酯基;消去反应;
(2). 由上述分析可知,A为环戊酮,结构简式为: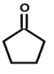 ,故答案为:
,故答案为: ;
;
(3). D为卤代烃,在NaOH水溶液中发生水解反应生成![]() ,化学方程式为:
,化学方程式为: ,故答案为:
,故答案为: ;
;
(4). M→N的转化只氧化了醛基而碳碳双键没有被氧化,KMnO4(H+)氧化性强,在氧化醛基的同时,还可以氧化碳碳双键,故答案为:KMnO4(H+)在氧化醛基的同时,还可以氧化碳碳双键;
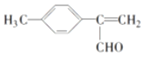
(5). M为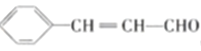 ,F是M的同系物,能发生银镜反应并能与溴的四氯化碳溶液发生加成反应,说明F中含有醛基和碳碳双键,比M多一个碳原子,苯环上有2个取代基,符合条件的同分异构体有18种,下列每种物质均有邻位、间位、对位各三种,共18种:
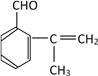
,F是M的同系物,能发生银镜反应并能与溴的四氯化碳溶液发生加成反应,说明F中含有醛基和碳碳双键,比M多一个碳原子,苯环上有2个取代基,符合条件的同分异构体有18种,下列每种物质均有邻位、间位、对位各三种,共18种: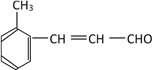 、
、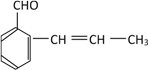 、
、 、
、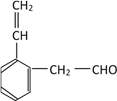 、
、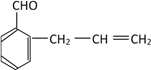 、
、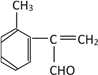 ,其中核磁共振氢谱显示5组峰的结构简式为:
,其中核磁共振氢谱显示5组峰的结构简式为: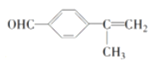 、
、  ,故答案为:18;
,故答案为:18; ;
; ;
;
(6). 以2-丙醇和NBS试剂为原料制备甘油(丙三醇),可以先用![]() 在浓硫酸作用下发生消去反应生成
在浓硫酸作用下发生消去反应生成![]() ,丙烯与NBS试剂反应生成
,丙烯与NBS试剂反应生成![]() ,再与溴水发生加成反应生成
,再与溴水发生加成反应生成![]() ,
,![]() 在NaOH溶液中发生水解反应生成丙三醇,合成路线为:
在NaOH溶液中发生水解反应生成丙三醇,合成路线为: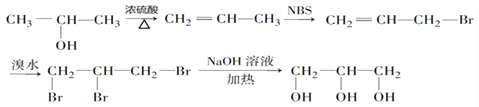 ,故答案为:
,故答案为: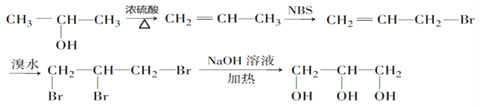 。
。

 期末1卷素质教育评估卷系列答案
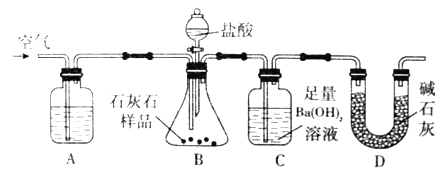
期末1卷素质教育评估卷系列答案【题目】生产上用过量烧碱溶液处理某矿物(含Al2O3、MgO),过滤后得到滤液用NaHCO3溶液处理,测得溶液pH和Al(OH)3生成的量随加入NaHCO3溶液体积变化的曲线如下:

下列有关说法不正确的是
A. 原NaHCO3溶液中c(H2CO3)+c(HCO3-)+c(CO32-)=0.8moL/L
B. a点水的电离程度小于c点水的电离程度
C. a点溶液中存在:c(Na+)+c(H+)=c(AlO2-)+(OH-)
D. 生成沉淀的离子方程式为:HCO3-+AlO2-+H2O=Al(OH)3↓+CO32-
【答案】A
【解析】A. 据图可知,加入40mLNaHCO3溶液时生成沉淀最多,沉淀为0.032mol,因NaOH过量,则滤液中含有NaOH,由反应顺序OH+HCO3=CO32+H2O、HCO3+AlO2+H2O═Al(OH)3↓+ CO32并结合图象可知,加入前8mLNaHCO3溶液时不生成沉淀,则原NaHCO3溶液中c(NaHCO3)= ![]() =1.0mol/L,所以c(H2CO3)+c(HCO3-)+c(CO32-)=1.0moL/L,故A错误;B. a点时尚未加入NaHCO3溶液,滤液中NaOH过量,水的电离受到抑制,随NaHCO3溶液的加入,溶液中NaOH逐渐减少,水的电离程度逐渐增大,所以a点水的电离程度小于c点水的电离程度,故B正确;C. a点对应的溶液为加入过量烧碱后所得的滤液,因氧化镁与NaOH溶液不反应,则加入过量烧碱所得的滤液中含有NaOH和NaAlO2,由电荷守恒可知c(Na+)+c(H+)=c(AlO2-)+(OH-),故C正确;D. 由上述分析可知,加入NaHCO3溶液生成沉淀的离子方程式为:HCO3+AlO2+H2O═Al(OH)3↓+ CO32,故D正确;答案选A。
=1.0mol/L,所以c(H2CO3)+c(HCO3-)+c(CO32-)=1.0moL/L,故A错误;B. a点时尚未加入NaHCO3溶液,滤液中NaOH过量,水的电离受到抑制,随NaHCO3溶液的加入,溶液中NaOH逐渐减少,水的电离程度逐渐增大,所以a点水的电离程度小于c点水的电离程度,故B正确;C. a点对应的溶液为加入过量烧碱后所得的滤液,因氧化镁与NaOH溶液不反应,则加入过量烧碱所得的滤液中含有NaOH和NaAlO2,由电荷守恒可知c(Na+)+c(H+)=c(AlO2-)+(OH-),故C正确;D. 由上述分析可知,加入NaHCO3溶液生成沉淀的离子方程式为:HCO3+AlO2+H2O═Al(OH)3↓+ CO32,故D正确;答案选A。
【题型】单选题
【结束】
8
【题目】芳香化合物在催化剂催化下与卤代烃发生取代反应称为Friedel-Crafts烷基化反应。某科研小组以苯和氯代叔丁烷[ClC(CH3)3]为反应物,无水AlCl3为催化剂条件下制备叔丁基苯(![]() )。
)。
反应如下: +ClC(CH3)3
+ClC(CH3)3 +HCl
+HCl
已知下列信息:
物质 | 相对分子质量 | 密度 | 熔点 | 沸点 | 溶解性 |
AlCl3 | —— | —— | 190℃ | 180℃ | 遇水极易潮解并产生白色烟雾,微溶于苯 |
苯 | 78 | 0.88g/cm3 | —— | 80.1℃ | 难溶于水,易溶于乙醇 |
氯代叔丁烷 | 92.5 | 1.84 g/cm3 | —— | 51.6℃ | 难溶于水,可溶于苯 |
叔丁基苯 | 134 | 0.87 g/cm3 | —— | 169℃ | 难溶于水,易溶于苯 |
I、如下图是实验室制备无水AlCl3的实验装置:

(1)E装置中的仪器名称是_______________。
(2)写出B装置中发生反应的离子方程式:________________________。
(3)选择合适的装置制备无水AlCl3正确的连接顺序为:_____________ (写导管口标号)。
(4)下列操作正确的是________。
甲:先加热硬质玻璃管再加热圆底烧瓶
乙:先加热圆底烧瓶再加热硬质玻璃管
(5)E装置的作用是:_______________________。
II、实验室制取叔丁基苯装置如图:

在三颈烧瓶中加入50mL的苯和适量的无水AlCl3,由恒压漏斗滴加氯代叔丁烷[ClC(CH3)3]10mL,一定温度下反应一段时间后,将反应后的混合物洗涤分离,在所得产物中加入少量无水MgSO4固体,静置,过滤,蒸馏得叔丁基苯20g。
(6)使用恒压漏斗的优点是____________________;加无水MgSO4固体的作用是___________。
(7)上述反应后混合物的洗涤所用的试剂有如下三种,正确的顺序是_____________。
①5%Na2CO3溶液 ②稀盐酸 ③H2O
(8)叔丁基苯的产率为______。(保留3位有效数字)