题目内容
【题目】过氧化钠常用作漂白剂、杀菌剂、消毒剂,能与水和二氧化碳等物质发生反应,保存不当时容易变质。某实验小组以过氧化钠为研究对象进行了如下实验。
(1)探究一包Na2O2样品是否已经变质:取少量样品,加水将其溶解,加入__________溶液,充分振荡后有白色沉淀,证明Na2O2已经变质。
(2)该实验小组为了粗略测定过氧化钠的质量分数,称取了m g样品,并设计用下图装置来测定过氧化钠的质量分数。
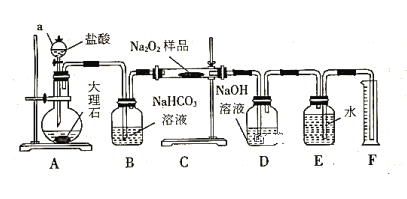
①装置D的作用是_________________________________;
②写出装置C中发生主要反应的化学方程式____________;
③读出量筒内水的体积后,将其折算成标准状况下氧气的体积为VmL,则样品中过氧化钠的质量分数为______________。
【答案】BaCl2(或CaCl2均可) 除去多余的CO2 2Na2O2+2CO2=2Na2CO3+O2 ![]() %
%
【解析】
(1)过氧化钠在空气中变质会最后生成碳酸钠固体,依据碳酸根离子检验是否变质;
(2)①装置D是吸收二氧化碳避免干扰氧气的体积测定;
②装置C中发生二氧化碳和过氧化钠反应生成碳酸钠和氧气的反应;
③结合生成氧气的体积计算物质的量,再结合化学方程式计算得到过氧化钠的物质的量,得到过氧化钠的质量分数。
(1)过氧化钠在空气中变质会生成碳酸钠固体,探究一包过氧化钠样品是否已经变质,可以利用碳酸根离子和钡离子(或钙离子)结合生成碳酸钡(或碳酸钙)白色沉淀证明Na2O2已经变质,故答案为:BaCl2(或CaCl2);
(2)①装置D的作用是:吸收氧气中混有的二氧化碳气体,故答案为:除去多余的CO2;
②装置C中是二氧化碳和过氧化钠反应生成碳酸钠和氧气的反应,反应的化学方程式为:2CO2+2Na2O2=2Na2CO3+O2,故答案为:2CO2+2Na2O2=2Na2CO3+O2;
③测定出量筒内水的体积后,折算成标准状况下氧气的体积为VmL,物质的量=![]() =
=![]() mol,则样品中过氧化钠的质量为=
mol,则样品中过氧化钠的质量为=![]() mol×2×78g/mol=
mol×2×78g/mol=![]() g,样品中过氧化钠的质量分数为
g,样品中过氧化钠的质量分数为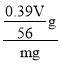 ×100%=
×100%=![]() %,故答案为:
%,故答案为:![]() %。
%。

 阅读快车系列答案
阅读快车系列答案【题目】现有部分元素的性质与原子(或分子)结构如下表:
元素编号 | 元素性质与原子(或分子)结构 |
T | 最外层电子数是次外层电子数的3倍 |
X | 常温下单质为双原子分子,分子中含有3对共用电子对 |
Y | M层比K层少1个电子 |
Z | 第3周期元素的简单离子中半径最小 |
(1)写出元素T的原子结构示意图____________________________
(2)元素Y与元素Z相比,金属性较强的是________(用元素符号表示)。
(3)X元素的气态氢化物溶于水后与其最高价氧化物对应水化物反应的离子方程式为__________。
(4)元素Y和硫元素可形成化合物Y2S,请用电子式表示该化合物的形成过程________