题目内容
【题目】(1)在同温同压下,同体积的气体甲烷(CH4)和二氧化碳密度之比为_________。
(2)在K2SO4和Fe2(SO4)3的混合溶液中,Fe3+的物质的量浓度为0.1molL-1,SO42-的物质的量浓度为0.3molL-1,则混合液中K+的物质的量浓度为______________ molL-1 。
(3)将铝粉加入氢氧化钠溶液中,写出该反应的离子方程式:__________。
(4)用KMnO4氧化盐酸溶液,反应方程式如下2KMnO4+16HCl===2KCl+2MnCl2+5Cl2↑+8H2O,若产生的Cl2在标准状况下体积为56 L,则反应中被氧化的HCl的物质的量是___ mol;用单线桥标出电子转移的方向和数目。___
【答案】4∶11 0.3 2Al+2OH-+2H2O=2AlO2-+3H2↑ 5 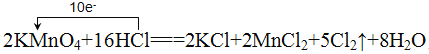
【解析】
(1)同温同压下,气体的密度之比等于相对分子质量之比;
(2)溶液呈电中性,根据电荷守恒列式计算;
(3)铝与氢氧化钠溶液反应生成偏铝酸钠和氢气;
(4)根据n=![]() 计算生成Cl2物质的量,再根据方程式计算HCl,结合元素化合价的变化分析解答。
计算生成Cl2物质的量,再根据方程式计算HCl,结合元素化合价的变化分析解答。
(1)同温同压下,同体积的甲烷(CH4)和二氧化碳密度之比等于相对分子质量之比=16∶44=4∶11,故答案为:4∶11;
(2)溶液呈电中性,根据电荷守恒有3c(Fe3+)+c(K+)=2c(SO42-),则:
0.1mol/L×3+c(K+)=2×0.3mol/L,解得:c(K+)=0.3mol/L,故答案为:0.3;
(3)铝与氢氧化钠溶液反应生成偏铝酸钠和氢气,反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑,故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(4)反应中16molHCl只有10mol被氧化,即被氧化的HCl占总的HCl物质的量![]() ,Cl2在标准状况下体积为56 L,氯气的物质的量=
,Cl2在标准状况下体积为56 L,氯气的物质的量=![]() =2.5mol,所以反应中参加反应的HCl的物质的量为8mol,则被氧化的HCl的物质的量为8mol×
=2.5mol,所以反应中参加反应的HCl的物质的量为8mol,则被氧化的HCl的物质的量为8mol×![]() =5mol,反应中Mn元素的化合价降低,Cl元素的化合价升高,该反应转移10e-,电子转移的方向和数目用单线桥表示为
=5mol,反应中Mn元素的化合价降低,Cl元素的化合价升高,该反应转移10e-,电子转移的方向和数目用单线桥表示为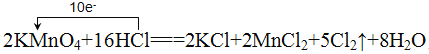 ,故答案为:5;
,故答案为:5;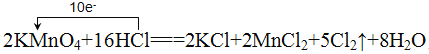 。
。

 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案