��Ŀ����
����Ŀ���黯��(GaAs)�������İ뵼����ϻ����������ͼ�������̫���ܵ�صIJ��ϵȡ�����Ԫ�������ڱ���λ������:
A1 | Si | P |
Ga | Ge | As |
�ش���������:
��1������Ԫ���У��ǽ�������ǿ��Ԫ����:________.д��Asԭ�ӵ������ĵ����Ų�ʽ_________,Asԭ�Ӻ�����_____��δ�ɶԵ��ӡ�
��2������Ԫ�������ɣ����ж�ԭ�Ӱ뾶Ga_____As��(ѡ�>������<����=��)��д����������������Ӧˮ����ĵ��뷽��ʽ:________________
��3��NH3�ķ��ӹ�����_______��GaF3���۵����1000��C,GaCl3���۵�Ϊ77.9��C,���ܵ�ԭ����_______.д��C2H2�ĵ���ʽΪ:_________
��4���Ƚ�������±������۵�ͷе㣬������仯���ɼ�ԭ��___________
GeCl4 | GeBr4 | GeI4 | |
�۵�/��C | -49.5 | 26 | 146 |
�е�/��C | 83.1 | 186 | Լ400 |
���𰸡� P 4s24p3 3 �� H++AlO2�C+H2O![]() Al(OH)3
Al(OH)3 ![]() Al3++3OH�C ������ GaF3 �����Ӿ��壬 GaCl3�Ƿ��Ӿ���
Al3++3OH�C ������ GaF3 �����Ӿ��壬 GaCl3�Ƿ��Ӿ��� ![]() GeCl4�� GeBr4�� GeI4���۷е�������������Ϊ����ɺͽṹ���Ƶ����ʣ����Ƿ��Ӿ��壬������������»��������۷е�����
GeCl4�� GeBr4�� GeI4���۷е�������������Ϊ����ɺͽṹ���Ƶ����ʣ����Ƿ��Ӿ��壬������������»��������۷е�����
��������(1)ͬһ���壬���ϵ��£��ǽ����Լ�����ͬһ���ڣ��������ң��ǽ�������ǿ���ǽ�������ǿ����PԪ�أ�AsΪ��A��33��Ԫ�أ������Ų�ʽΪ��1s22s22p63s23p63d104s24p3����������ĵ����Ų�ʽΪ4s24p3����3��δ�ɶԵ��ӣ��ʴ�Ϊ��P��4s24p3��3��
(2)����Ԫ�������ɣ�Ga��Asλ��ͬһ���ڣ�Gaԭ������С��As���ʰ뾶Ga����As����������������Ӧˮ�����������������ĵ��뷽��ʽΪH++AlO2�C+H2O![]() Al(OH)3
Al(OH)3 ![]() Al3++3OH�C���ʴ�Ϊ������H++AlO2�C+H2O
Al3++3OH�C���ʴ�Ϊ������H++AlO2�C+H2O![]() Al(OH)3
Al(OH)3 ![]() Al3++3OH�C��
Al3++3OH�C��
(3)NH3�м۲���ӶԸ���=��������+�µ��ӶԸ���=3+![]() =4������ԭ���ӻ���ʽ��sp3��������һ�Թ¶Ե��Ӷԣ����ӿռ乹��Ϊ��������GaF3 �����Ӿ��壬GaCl3�Ƿ��Ӿ��壬ʹ��GaF3 ���۵㲻GaCl3�ߺܶࣻC2H2�ĵ���ʽΪ
=4������ԭ���ӻ���ʽ��sp3��������һ�Թ¶Ե��Ӷԣ����ӿռ乹��Ϊ��������GaF3 �����Ӿ��壬GaCl3�Ƿ��Ӿ��壬ʹ��GaF3 ���۵㲻GaCl3�ߺܶࣻC2H2�ĵ���ʽΪ![]() ���ʴ�Ϊ�������Σ�GaF3 �����Ӿ��壬 GaCl3�Ƿ��Ӿ��壻
���ʴ�Ϊ�������Σ�GaF3 �����Ӿ��壬 GaCl3�Ƿ��Ӿ��壻![]() ��
��
(4)���ݱ������ݣ�GeCl4�� GeBr4�� GeI4����ɺͽṹ���ƣ����Ƿ��Ӿ��壬��Է����������������»��������۷е��������ʴ�Ϊ��GeCl4�� GeBr4�� GeI4���۷е�������������Ϊ����ɺͽṹ���Ƶ����ʣ����Ƿ��Ӿ��壬������������»��������۷е�������

����Ŀ��Ϊ�˸��ƻ�������ѧ��Ͷ���˴����ľ����о�̼�������仯�����ת������ش������й�����:
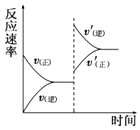
��1������N2��H2�ϳɰ�����Ҫ�Ĺ�ҵ��Ӧ����ͼΪ��Ӧ�����е������仯��ϵ��
����Ӧ�м������ۿ�����߷�Ӧ���ʣ���ԭ����____________��
����֪ijЩ��ѧ�������������±�:
��ѧ�� | H-H | N��N | N-H |
E/(kJ/mol) | 436 | 946 | 391 |
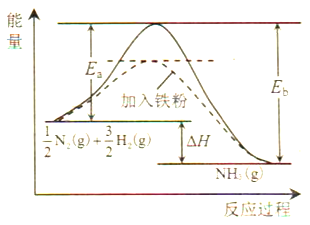
��Ӧ![]() N2(g)+
N2(g)+![]() H2(g)
H2(g)![]() NH3(g)�Ļ��Ea=254kJ/mol����ӦNH3(g)
NH3(g)�Ļ��Ea=254kJ/mol����ӦNH3(g)![]()
![]() N2(g)+
N2(g)+![]() H2(g)�Ļ��Eb=______kJ/mol��
H2(g)�Ļ��Eb=______kJ/mol��
��2��������ȼ������ʱ�ὫN2ת��ΪNO����ӦʽΪN2(g)+O2(g) ![]() 2NO(g)���÷�Ӧ�ڲ�ͬ�¶��µ�ƽ�ⳣ��K���±�:
2NO(g)���÷�Ӧ�ڲ�ͬ�¶��µ�ƽ�ⳣ��K���±�:
�¶� | 27�� | 2000�� |
K | 3.8��10-31 | 0.1 |
�¶�Ϊ2000����ijʱ�̲�÷�Ӧ��ϵ�и����ʵ�Ũ�ȷֱ�Ϊc(N2)=0.2mol/L��c(O2)=0.03mol/L��c(NO)=0.03mol/L����ʱ�÷�Ӧ������(v)Ӧ����Ĺ�ϵΪ_______(����ĸ���)��
A.v��>v�� B.v��=v�� C.v��<v�� D.��ȷ��
��3����ҵ�Ͽɽ�COת���ɼ״�����ӦʽΪ:CO(g)+2H2(g)![]() CH3OH(g)������һ�ݻ��ɱ���ܱ������г���1molCO��2molH2���з�Ӧ����ʼ���Ϊ3L������ѹǿ���䣬��Ӧ��CO
CH3OH(g)������һ�ݻ��ɱ���ܱ������г���1molCO��2molH2���з�Ӧ����ʼ���Ϊ3L������ѹǿ���䣬��Ӧ��CO
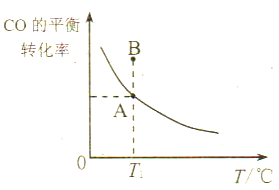
�������ӵ�CO��H2�����Լ���Ӧ�¶Ⱦ����䣬��ﵽƽ��״̬A��Bʱ��ѹǿpA____pB(����>������<������=��)����ԭ����___________________��
�����ﵽ��ѧƽ��״̬Aʱ��CO���������Ϊ25%����ʱCO��ת����Ϊ_____��ƽ�ⳣ��KA=________��