题目内容
如图是温度和压强对反应X+Y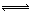 2Z的影响的示意图。图中横坐标表示温度,纵坐标表示平衡混合气体中Z的体积分数。下列叙述正确的是
2Z的影响的示意图。图中横坐标表示温度,纵坐标表示平衡混合气体中Z的体积分数。下列叙述正确的是
A.上述可逆反应的正反应为放热反应
B.X、Y、Z均为气体
C.X和Y中只有一种为气态,Z为气态
D.上述反应的逆反应ΔH>0
【答案】
C
【解析】
试题分析:根据图像可知随着温度升高Z的体积分数增大,所以正反应是吸热的,随着压强的增大Z的体积分数减小,平衡逆向移动,所以Z一定为气体,X、Y中只能有一种是气体,答案选C。
考点:化学平衡图像
点评:在分析有关图像时应该注意:一、ν-t 图像或 c-t 图像:1.ν-t 图像:分清正逆反应,分清各因素(浓度、温度、压强、催化剂)对反应速率和平衡移动的影响。 二、平衡图像 1.出现拐点的图像:分析依据“先拐先平”。在转化率-时间图像或物质的百分含量-时间图像中,先出现拐点的曲线先达到平衡(代表温度高或压强大或使用合适的催化剂等)。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
甲烷自热重整是先进的制氢方法,包含甲烷氧化和蒸汽重整.向反应系统同时通入甲烷、氧气和水蒸气,发生的主要化学反应有:
回答下列问题:
(1)反应CO(g)+H2O(g)=CO2(g)+H2(g)的△H=______kJ/mol.
(2)在初始阶段,甲烷蒸汽重整的反应速率______甲烷氧化的反应速率(填大于、小于或等于).
(3)对于气相反应,用某组分(B)的平衡压强(PB)代替物质的量浓度(cB)也可表示平衡常数(记作KP),则反应CH4(g)+H2O(g)?CO(g)+3H2(g)的KP=______;随着温度的升高,该平衡常数______(填“增大”、“减小”或“不变”).
(4)从能量角度分析,甲烷自热重整方法的先进之处在于______.
(5)在某一给定进料比的情况下,温度、压强对H2和CO物质的量分数的影响如图1、图2:

①若要达到H2物质的量分数>65%、CO的物质的量分数<10%,以下条件中最合适的是______.
A.600℃,0.9MpaB.700℃,0.9MPaC.800℃,1.5MpaD.1000℃,1.5MPa
②画出600℃,0.1Mpa条件下,系统中H2物质的量分数随反应时间(从常温进料开始计时)的变化趋势示意图(如图3):
(6)如果进料中氧气量过大,最终导致H2物质的量分数降低,原因是______.
| 反应过程 | 化学方程式 | 焓变△H(kJ/mol) | 活化能Ea(kJ/mol) |
| 甲烷氧化 | CH4(g)+2O2(g)=CO2(g)+2H2O(g) | -802.6 | 125.6 |
| CH4(g)+O2(g)=CO2(g)+2H2(g) | -322.0 | 172.5 | |
| 蒸汽重整 | CH4(g)+H2O(g)=CO(g)+3H2(g) | 206.2 | 240.1 |
| CH4(g)+2H2O(g)=CO2(g)+4H2(g) | 165.0 | 243.9 |
(1)反应CO(g)+H2O(g)=CO2(g)+H2(g)的△H=______kJ/mol.
(2)在初始阶段,甲烷蒸汽重整的反应速率______甲烷氧化的反应速率(填大于、小于或等于).
(3)对于气相反应,用某组分(B)的平衡压强(PB)代替物质的量浓度(cB)也可表示平衡常数(记作KP),则反应CH4(g)+H2O(g)?CO(g)+3H2(g)的KP=______;随着温度的升高,该平衡常数______(填“增大”、“减小”或“不变”).
(4)从能量角度分析,甲烷自热重整方法的先进之处在于______.
(5)在某一给定进料比的情况下,温度、压强对H2和CO物质的量分数的影响如图1、图2:

①若要达到H2物质的量分数>65%、CO的物质的量分数<10%,以下条件中最合适的是______.
A.600℃,0.9MpaB.700℃,0.9MPaC.800℃,1.5MpaD.1000℃,1.5MPa
②画出600℃,0.1Mpa条件下,系统中H2物质的量分数随反应时间(从常温进料开始计时)的变化趋势示意图(如图3):
(6)如果进料中氧气量过大,最终导致H2物质的量分数降低,原因是______.
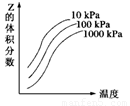
反应:L(s)+aG(g)![]() bR(g) 达到平衡时,温度和压强对该反
bR(g) 达到平衡时,温度和压强对该反
应的影响如右图所示:图中压强p1>p2,x轴表示温度,y轴
表示平衡混合气中G的体积分数。据此可判断:
 |
A.上述反应是放热反应 B.上述反应是吸热反应
C.a>b D.1+a<b
 (2013?日照二模)CO、NO、NO2、SO2等都是污染大气的有害气体,对其进行回收利用是节能减排的重要课题.
(2013?日照二模)CO、NO、NO2、SO2等都是污染大气的有害气体,对其进行回收利用是节能减排的重要课题.
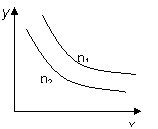
 合成氨工业是极为重要的化学工业,当今对合成氨工业的研究仍然充满活力.其合成原理为:N2(g)+3H2(g)?2NH3(g);△H=-92.2kJ/mol.回答下列问题:
合成氨工业是极为重要的化学工业,当今对合成氨工业的研究仍然充满活力.其合成原理为:N2(g)+3H2(g)?2NH3(g);△H=-92.2kJ/mol.回答下列问题: