题目内容
 (2013?日照二模)CO、NO、NO2、SO2等都是污染大气的有害气体,对其进行回收利用是节能减排的重要课题.
(2013?日照二模)CO、NO、NO2、SO2等都是污染大气的有害气体,对其进行回收利用是节能减排的重要课题.(1)上述四种气体直接排入空气中会引起酸雨的有
NO、NO2、SO2
NO、NO2、SO2
.(2)NO2可用尿素[CO(NH2)2]还原(尿素中C元素的化合价为+4价),反应的方程式为:4CO(NH2)2+6NO2═7N2+4CO2+8H2O.当消耗掉12g尿素时,转移电子的物质的量是
1.2
1.2
.(3)SNCR-SCR是一种新型的烟气脱硝技术(除去烟气中的NOX),改流程中发生的主要反应有:
4NO(g)+4NH3(g)+O2g?4N2(g)+6H2O(g)△H2=-18070.0kJmol-1
6NO(g)+4NH3(g)?5N2(g)+6H2O(g)△H1=-1627.2kJmol-1
6NO(g)+8NH3(g)?7N2(g)+12H2O(g)△H3=-2659.9kJmol-1
则反应N2g+O2g?2NO(g)的△H=
-179.8
-179.8
kJ.mol-1(4)CO可用于合成甲醇,反应方程式为CO(g)+2H2g?CH3OH(g).在一容积可变的密闭容器中充有10molCO和20molH2,在催化剂作用下发生反应生成甲醇,CO的平衡转化率(a)与温度(T)、压强(P)的关系如图所示.则该反应是△H<
<
0(填“>”或“<”).若达到平衡状态A时,容器的体积为10L,则在平衡状态B时容器的体积为2
2
L.(5)工业上用氨水将来SO2转化成都(NH4)2SO3,再氧化成(NH4)2SO4.(NH4)2SO4溶液中离子浓度大小顺序为
c(NH4+)>c(SO42-)>c(H+)>c(OH-)
c(NH4+)>c(SO42-)>c(H+)>c(OH-)
;已知25℃时,0.05mol?L-1(NH4)2SO4溶液的pH=a,则c(N
| ||
| c(NH3?H2O) |
1.7×109-a
1.7×109-a
(用含a的代数式表示,已知NH3?H2O的电离常数Kb=1.7×10-5mol?L-1).分析:(1)能引起酸雨的气体是氮氧化物和二氧化硫;
(2)根据尿素和转移电子之间的关系式计算;
(3)根据盖斯定律解答;
(4)根据温度和CO的转化率确定反应热,温度不变,化学平衡常数不变,根据CO的转化率确定反应方向,从而确定容器的体积变化;
(5)根据盐的类型及盐的化学式确定离子浓度大小;根据一水合氨的电离常数及溶液中氢氧根离子浓度计算.
(2)根据尿素和转移电子之间的关系式计算;
(3)根据盖斯定律解答;
(4)根据温度和CO的转化率确定反应热,温度不变,化学平衡常数不变,根据CO的转化率确定反应方向,从而确定容器的体积变化;
(5)根据盐的类型及盐的化学式确定离子浓度大小;根据一水合氨的电离常数及溶液中氢氧根离子浓度计算.
解答:解:(1)能引起酸雨的气体是氮氧化物和二氧化硫,故答案为:NO、NO2、SO2;
(2)尿素中C元素的化合价为+4价,反应中只有N元素变价,4molCO(NH2)2中-3价的N失去24mol电子,6molNO2中+4价的N得到24mol电子,生成7mol N2共转移24mol电子,则12g的物质的量=
=0.2mol,所以消耗12g尿素时消耗时,共转移1.2 mol电子,故答案为:1.2 mol;
(3)6NO(g)+4NH3(g)?5N2(g)+6H2O(g)△H1=-1627.2kJmol-1①
4NO(g)+4NH3(g)+O2(g)?4N2(g)+6H2O(g)△H2=-18070.0kJmol-1 ②
6NO(g)+8NH3(g)?7N2(g)+12H2O(g)△H3=-2659.9kJmol-1③
将方程式②-①得N2(g)+O2(g)?2NO(g)△H=△H2-△H1=-18070.0kJmol-1-(-1627.2kJmol-1)=-179.8kJ/mol,
故答案为:-179.8;
(4)据图象可知,温度升高平衡逆向移动,所以△H<0;T1时,A点对应的α=0.5,据平衡常数表达式可得K=1.因B点与A点温度相同,K不变,可计算出体积为2L,故答案为:<;2;
(5)(NH4)2SO4溶液中NH4+水解显酸性,则离子浓度大小顺序为c(NH4+)>c(SO42-)>c(H+)>c(OH-);
0.05mol?L-1(NH4)2SO4溶液的pH=a,则c(OH-)=10a-14,Kb=
1.7×10-5mol.L-1,所以
=
=1.7×109-a,
故答案为:c(NH4+)>c(SO42-)>c(H+)>c(OH-);1.7×109-a.
(2)尿素中C元素的化合价为+4价,反应中只有N元素变价,4molCO(NH2)2中-3价的N失去24mol电子,6molNO2中+4价的N得到24mol电子,生成7mol N2共转移24mol电子,则12g的物质的量=
| 12g |
| 60g/mol |
(3)6NO(g)+4NH3(g)?5N2(g)+6H2O(g)△H1=-1627.2kJmol-1①
4NO(g)+4NH3(g)+O2(g)?4N2(g)+6H2O(g)△H2=-18070.0kJmol-1 ②
6NO(g)+8NH3(g)?7N2(g)+12H2O(g)△H3=-2659.9kJmol-1③
将方程式②-①得N2(g)+O2(g)?2NO(g)△H=△H2-△H1=-18070.0kJmol-1-(-1627.2kJmol-1)=-179.8kJ/mol,
故答案为:-179.8;
(4)据图象可知,温度升高平衡逆向移动,所以△H<0;T1时,A点对应的α=0.5,据平衡常数表达式可得K=1.因B点与A点温度相同,K不变,可计算出体积为2L,故答案为:<;2;
(5)(NH4)2SO4溶液中NH4+水解显酸性,则离子浓度大小顺序为c(NH4+)>c(SO42-)>c(H+)>c(OH-);
0.05mol?L-1(NH4)2SO4溶液的pH=a,则c(OH-)=10a-14,Kb=
| c(NH4+)?c(OH-) |
| c(NH3?H2O) |
| c(NH4+) |
| c(NH3?H2O) |
| 1.7×10-5 |
| 1×10a-14 |
故答案为:c(NH4+)>c(SO42-)>c(H+)>c(OH-);1.7×109-a.
点评:本题以研究污染大气的有害气体性质为载体考查氧化还原反应、热化学反应、化学平衡及电解质溶液的相关知识,难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
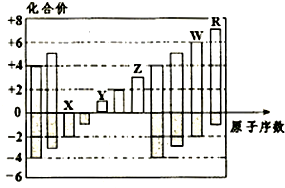 (2013?日照二模)如图所示是五种短周期元素化合价与原子序数的关系,下列说法不正确的是( )
(2013?日照二模)如图所示是五种短周期元素化合价与原子序数的关系,下列说法不正确的是( )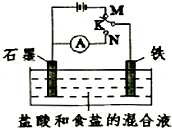 (2013?日照二模)用如图所示装置进行实验,下列叙述不正确的是( )
(2013?日照二模)用如图所示装置进行实验,下列叙述不正确的是( )