题目内容
16.已知X、Y、Z为三种原子序数相连的元素,最高价氧化物对应水化物的酸性相对强弱是:HXO4>H2YO4>H3ZO4.则下列说法不正确的是( )| A. | 气态氢化物的稳定性:HX>H2Y>ZH3 | B. | 非金属活泼性:Y<X<Z | ||
| C. | 单质的氧化性:X>Y>Z | D. | 原子最外电子层上电子数不等 |
分析 X、Y、Z为三种原子序数相连的元素,最高价氧化物对应水化物的酸性相对强弱是:HXO4>H2YO4>H3ZO4,则非金属性X>Y>Z,非金属性越强,氢化物越稳定、单质氧化性越强,最外层电子数等于最高正化合价,据此解答.
解答 解:X、Y、Z为三种原子序数相连的元素,最高价氧化物对应水化物的酸性相对强弱是:HXO4>H2YO4>H3ZO4,则非金属性X>Y>Z,
A.非金属性越强,氢化物越稳定,故氢化物稳定性HX>H2Y>ZH3,故A正确;
B.非金属活泼性:Z<Y<X,故B错误;
C.非金属性越强,单质氧化性越强,故单质的氧化性:X>Y>Z,故C正确;
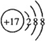
D.X、Y、Z的最高正化合价分别为+7、+6、+5,最外层电子数等于最高正化合价,X、Y、Z原子最外层电子数依次减小,故D正确,
故选B.
点评 本题考查原子结构与性质关系,难度中等,关键是对元素周期律的理解掌握,掌握同周期元素性质的递变规律.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
6.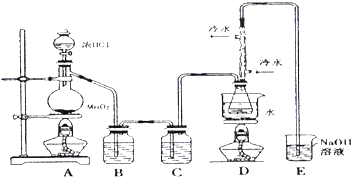 S2Cl2是工业上常用的硫化剂,可以改变生橡胶受热发粘、遇冷变硬的性质.
S2Cl2是工业上常用的硫化剂,可以改变生橡胶受热发粘、遇冷变硬的性质.
已知:①S2Cl2易与水反应;②300℃以上完全分解;③微热的情况下S2Cl2能被过量Cl2氧化S2Cl2+Cl2$\frac{\underline{\;\;△\;\;}}{\;}$ 2SCl2;④有关物质的熔沸点如下:
实验室制备S2Cl2的反应原理有两种:
①CS2+3C12$\frac{\underline{\;95-100℃\;}}{\;}$CC14+S2Cl2; ②2S+Cl2$\frac{\underline{\;111-140℃\;}}{\;}$S2Cl2.
(1)若实验室选择如图装置(部分夹持装置已略去)来制备S2Cl2,其反应原理是上述中的①(填写序号);上图中尾气处理装置不够完善,改进后的装置应起到的作用是:在D、E之间再加一个干燥装置,同时要能吸收尾气、防倒吸.利用改进后的正确装置进行实验,请回答以下问题
(2)为了提高产品S2Cl2的纯度,实验操作的关键是控制好温度和控制浓盐酸的滴速不能太快.
(3)该实验的操作顺序为:①③②⑤④(用序号表示).
①点燃酒精灯A ②点燃酒精灯D ③通冷凝水 ④熄灭酒精灯A ⑤熄灭酒精灯D
(4)D装置中冲凝管的作用是:冷凝回流、导气;反应结束后,从D装置锥形瓶内的混合物中分离出产物的方法是:蒸馏;某同学取少量产物,小心加入适量水中,观察到有白雾,黄色沉淀、产生的无色气体能使品红
溶液褪色,该同学据此判断.上述实验确有S2Cl2生成,写出S2Cl2与水反应的化学方程式:2S2Cl2+2H2O=S↓+SO2↑+4HCl
(5)S2Cl2中每个原子的最外层都具有8电子结构,请写出S2Cl2的电子式: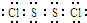 .
.
 S2Cl2是工业上常用的硫化剂,可以改变生橡胶受热发粘、遇冷变硬的性质.
S2Cl2是工业上常用的硫化剂,可以改变生橡胶受热发粘、遇冷变硬的性质.已知:①S2Cl2易与水反应;②300℃以上完全分解;③微热的情况下S2Cl2能被过量Cl2氧化S2Cl2+Cl2$\frac{\underline{\;\;△\;\;}}{\;}$ 2SCl2;④有关物质的熔沸点如下:
| 物质 | 沸点/℃ | 熔点/℃ |
| S | 445 | 113 |
| CS2 | 47 | -109 |
| CCl4 | 77 | -23 |
| S2Cl2 | 137 | -77 |
①CS2+3C12$\frac{\underline{\;95-100℃\;}}{\;}$CC14+S2Cl2; ②2S+Cl2$\frac{\underline{\;111-140℃\;}}{\;}$S2Cl2.
(1)若实验室选择如图装置(部分夹持装置已略去)来制备S2Cl2,其反应原理是上述中的①(填写序号);上图中尾气处理装置不够完善,改进后的装置应起到的作用是:在D、E之间再加一个干燥装置,同时要能吸收尾气、防倒吸.利用改进后的正确装置进行实验,请回答以下问题
(2)为了提高产品S2Cl2的纯度,实验操作的关键是控制好温度和控制浓盐酸的滴速不能太快.
(3)该实验的操作顺序为:①③②⑤④(用序号表示).
①点燃酒精灯A ②点燃酒精灯D ③通冷凝水 ④熄灭酒精灯A ⑤熄灭酒精灯D
(4)D装置中冲凝管的作用是:冷凝回流、导气;反应结束后,从D装置锥形瓶内的混合物中分离出产物的方法是:蒸馏;某同学取少量产物,小心加入适量水中,观察到有白雾,黄色沉淀、产生的无色气体能使品红
溶液褪色,该同学据此判断.上述实验确有S2Cl2生成,写出S2Cl2与水反应的化学方程式:2S2Cl2+2H2O=S↓+SO2↑+4HCl
(5)S2Cl2中每个原子的最外层都具有8电子结构,请写出S2Cl2的电子式:
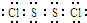 .
.
4.有如下反应

下列说法正确的是( )

下列说法正确的是( )
| A. | 荧光素属于高分子化合物 | |
| B. | 荧光素与氧化荧光素都至少有6个碳原子共平面 | |
| C. | 荧光素与氧化荧光素都能与碳酸氢钠反应 | |
| D. | 荧光素与氧化荧光素互为同系物 |
1.下列关于有机化合物性质和结构的叙述中正确的是( )
| A. | 葡萄糖、蔗糖、淀粉都可以食用,都能发生水解 | |
| B. | 苯与液溴在铁作催化剂的条件下的反应为加成反应 | |
| C. | 甲烷、苯、淀粉、蛋白质完全燃烧的产物都只有二氧化碳和水 | |
| D. | 油脂属于酯,在酸性条件下的水解产物都是醇和羧酸 |
5.下列说法中不正确的是( )
①任何化学反应都伴有能量变化
②根据能量守恒定律,反应物的总能量等于生成物的总能量
③化石燃料在燃烧过程中能产生污染环境的CO、SO2等有害气体
④煤转化为煤气后燃烧,可以提高燃烧效率
⑤等质量的氢气燃烧生成水蒸气所放出的热量低于生成液态水所放出的热量
⑥等质量的硫蒸气和硫粉分别与氧气反应生成SO2气体,硫粉放出的热量多.
①任何化学反应都伴有能量变化
②根据能量守恒定律,反应物的总能量等于生成物的总能量
③化石燃料在燃烧过程中能产生污染环境的CO、SO2等有害气体
④煤转化为煤气后燃烧,可以提高燃烧效率
⑤等质量的氢气燃烧生成水蒸气所放出的热量低于生成液态水所放出的热量
⑥等质量的硫蒸气和硫粉分别与氧气反应生成SO2气体,硫粉放出的热量多.
| A. | ①③⑤ | B. | ①②③④⑤⑥ | C. | ②⑥ | D. | ②③④⑥ |
6.已知 X、Y、Z、Q、R、E六种元素中,原子序数X<Y<Z<Q<R<E,其结构或性质信息如下表.
请根据信息回答有关问题:
(1)元素Y的原子核外共有7种不同运动状态的电子,有3种不同能级的电子;
(2)X、Y、Z三种元素的电负性由高到低的排列次序依次为(写元素符号)O>N>C;
(3)X、Z、Q元素均表现最低化合价时的三种氢化物中,沸点由高到低的排列次序依次为(写化学式)H2O>HCl>CH4;
(4)R的最高化合价为+6.R的一种配合物的化学式为RCl3•6H2O.已知0.01molRCl3•6H2O在水溶液中用过量硝酸银溶液处理,产生0.02molAgCl沉淀.此配合物最可能是B;
A.[R(H2O)6]Cl3 B.[R(H2O)5Cl]Cl2•H2O
C.[R(H2O)4Cl2]Cl•2H2O D.[R(H2O)3Cl3]•3H2O
(5)元素E能形成八面体构型的配合物离子[E(YH3)xQ2]+,则中心离子为(写化学式)Co3+,配位体为(写化学式)NH3和Cl-,x的值为4;
(6)Y的最低价氢化物与Z的一种氢化物反应,生成的两种产物均不污染环境,其反应的化学方程式为2NH3+3H2O2═N2+6H2O.
| 元素 | 结构或性质信息 |
| X | 原子的L层上s电子数等于p电子数. |
| Y | 原子核外的L层有3个未成对电子. |
| Z | 在元素周期表的各元素中电负性仅小于氟. |
| Q | 单质常温、常压下是气体,原子的M层上有1个未成对的p电子. |
| R | 核电荷数是Y与Q的核电荷数之和 |
| E | 原子序数比R大3 |
(1)元素Y的原子核外共有7种不同运动状态的电子,有3种不同能级的电子;
(2)X、Y、Z三种元素的电负性由高到低的排列次序依次为(写元素符号)O>N>C;
(3)X、Z、Q元素均表现最低化合价时的三种氢化物中,沸点由高到低的排列次序依次为(写化学式)H2O>HCl>CH4;
(4)R的最高化合价为+6.R的一种配合物的化学式为RCl3•6H2O.已知0.01molRCl3•6H2O在水溶液中用过量硝酸银溶液处理,产生0.02molAgCl沉淀.此配合物最可能是B;
A.[R(H2O)6]Cl3 B.[R(H2O)5Cl]Cl2•H2O
C.[R(H2O)4Cl2]Cl•2H2O D.[R(H2O)3Cl3]•3H2O
(5)元素E能形成八面体构型的配合物离子[E(YH3)xQ2]+,则中心离子为(写化学式)Co3+,配位体为(写化学式)NH3和Cl-,x的值为4;
(6)Y的最低价氢化物与Z的一种氢化物反应,生成的两种产物均不污染环境,其反应的化学方程式为2NH3+3H2O2═N2+6H2O.
 .
.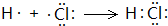 .
.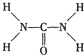 ,尿素分子中σ键和π键数目之比为7:1.
,尿素分子中σ键和π键数目之比为7:1. .
. ;F3C4的化学式为Fe3O4;F元素在周期表中的位置是第4周期第Ⅷ族.
;F3C4的化学式为Fe3O4;F元素在周期表中的位置是第4周期第Ⅷ族.